Anatomia endoscópica pós cirurgia bariátrica
Obesidade é uma doença complexa, crônica e incurável. O aumento contínuo da incidência e da necessidade de tratamentos mais precoces e efetivos, coloca o endoscopista em um papel importante na equipe multidisciplinar de tratamento da obesidade. A cirurgia bariátrica é o padrão ouro de tratamento nos casos graves e com comorbidades associadas. A cirurgia bariátrica metabólica pode ser indicada em pacientes com obesidade grau 1 e falha do tratamento clínico do diabetes. Atualmente as técnicas mais realizadas são o Bypass gástrico em Y de Roux e Gastrectomia Vertical.
Bypass gástrico em Y de Roux
No Bypass gástrico em Y de Roux o estômago é grampeado e seccionado com o intuito de formar um pequeno reservatório (bolsa gástrica) de aproximadamente 20 a 40ml. O estômago remanescente, assim como o duodeno e os primeiros 50 cm de jejuno, ficam permanentemente excluídos do trânsito alimentar. O pequeno reservatório gástrico é então anastomosado a uma alça jejunal isolada em Y, término-lateral. Atualmente em desuso, o anel bariátrico é colocado proximalmente a uma distância de 1,5 cm da anastomose gastrojejunal, reduzindo o diâmetro da luz gástrica para cerca de 12 mm. As secreções provenientes do estômago e do duodeno exclusos desembocam no jejuno por uma segunda anastomose que pode variar conforme a técnica, de 50 cm a 150 cm abaixo do reservatório gástrico.
Durante a endoscopia, é avaliado o tamanho e a integridade da bolsa gástrica, especialmente a linha de sutura, o calibre e a posição do anel (se presente), bem como o diâmetro da anastomose e a mucosa do jejuno proximal.
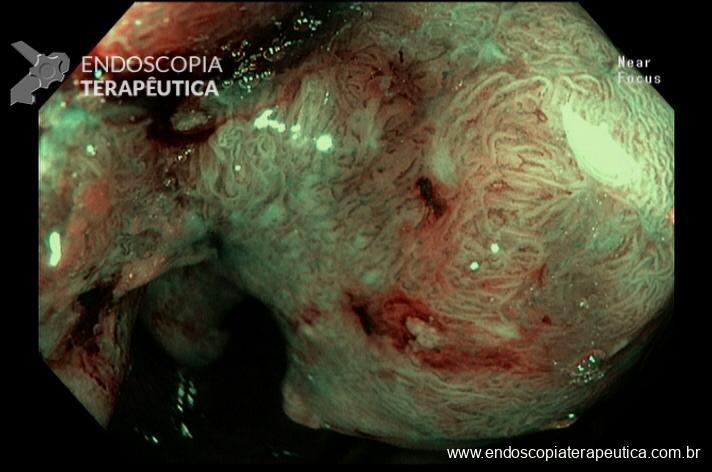
O esôfago tem aspecto normal seguido de uma bolsa gástrica tubular de 5-7cm de extensão logo abaixo da linha Z, por vezes é visualizada a linha de sutura.

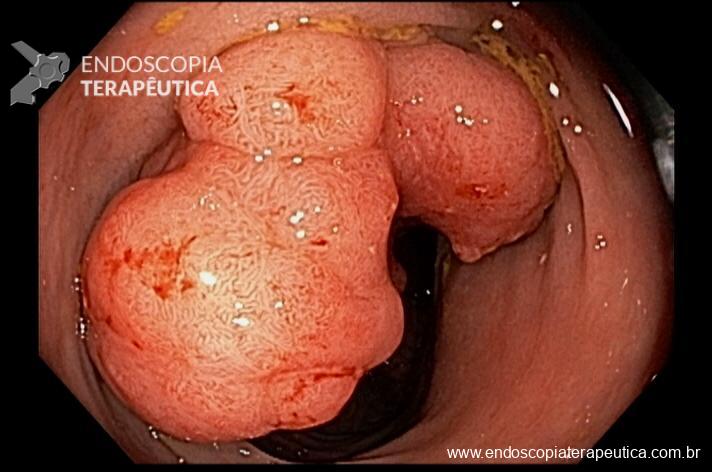
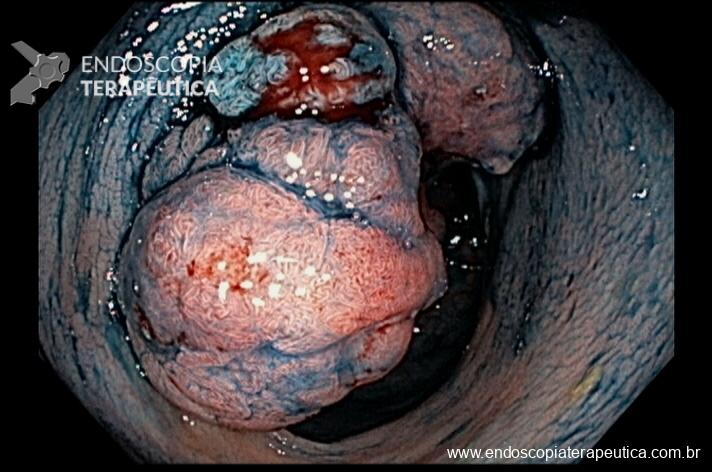
Imagem 1: Bolsa gástrica e anastomose gastrojejunal
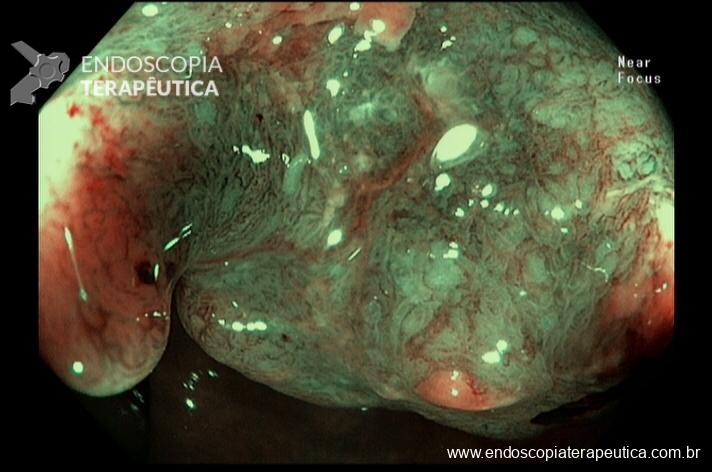
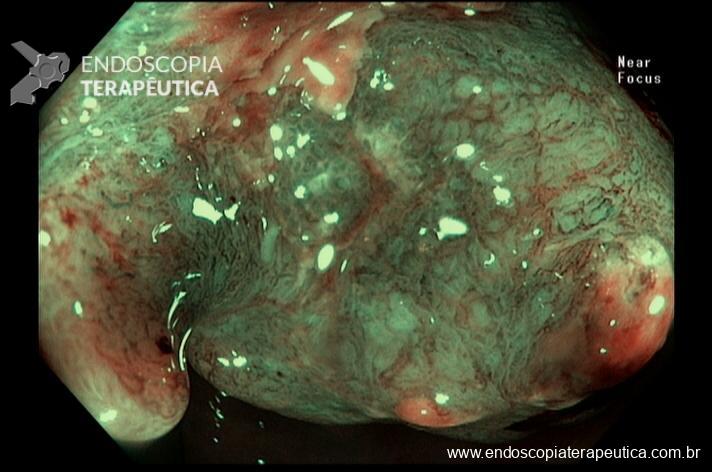
Quando colocado, o anel é posicionado externamente à bolsa, visto como uma impressão anelar em torno de 12 mm na parte mais distal. A imagem endoscópica é de um estreitamento com convergência de pregas, sendo importante descrever a distância entre o anel e a anastomose gastrojejunal, pois o deslizamento distal do anel associado a sintomas importantes, pode indicar a necessidade da sua retirada.
Imagens 2 e 3. Anel bariátrico em posição anterior à anastomose gastrojejunal em by-pass gástrico em Y de Roux.
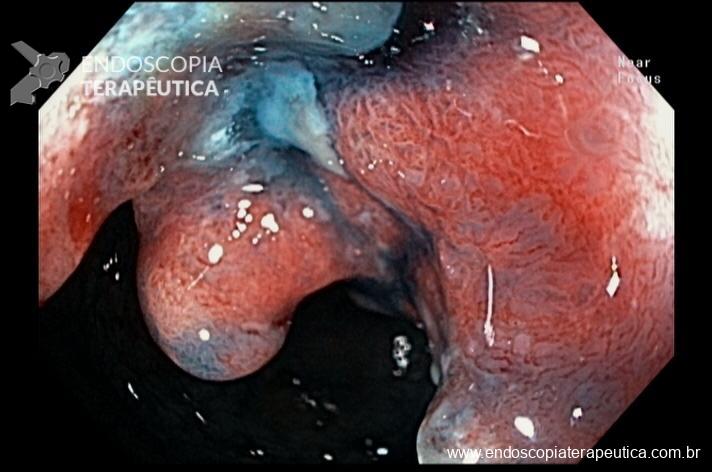
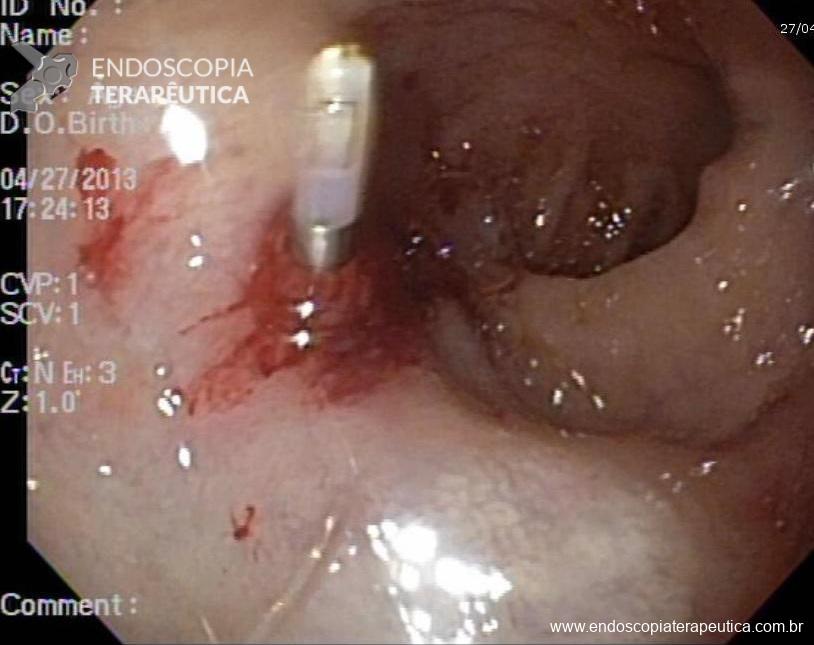
A anastomose gastrojejunal deve ser examinada com atenção, pois é local comum de úlceras e corpos estranhos como grampos e fios de sutura. Recomendamos rotineiramente medir o diâmetro da anastomose, comparando com uma pinça de corpo estranho aberta ou outro acessório que permita uma medição objetiva ou por comparação.

Imagem 4: Anastomose gastro-jejunal regular com diâmetro aproximado de 1,7cm. Cortesia do Dr, Maurício Spagnol.
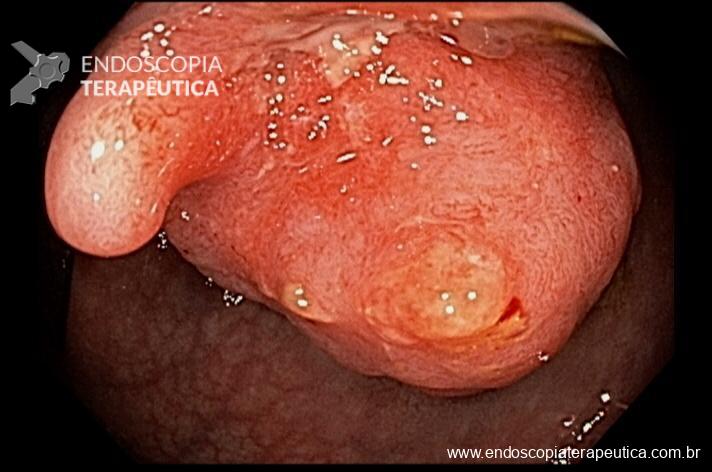
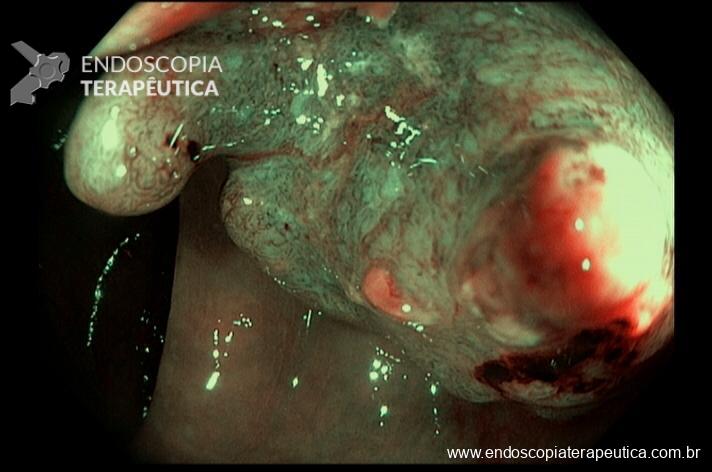
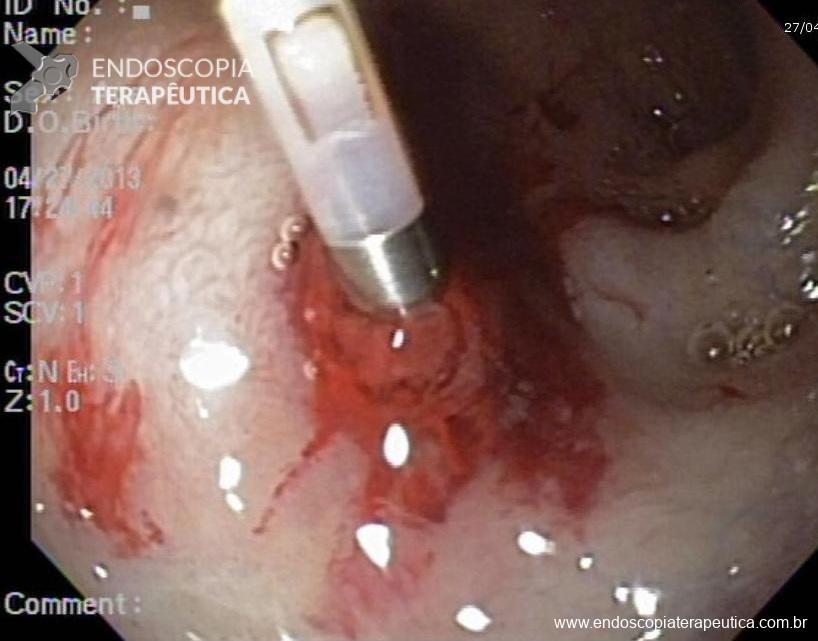
A partir da anastomose, identificam-se duas alças intestinais: A alça interposta é curta, em ângulo agudo e, por ter o fundo cego, evitamos o termo aferente. Já a alça alimentar é longa e disposta quase no mesmo eixo da bolsa, variando de 50 a 150cm de comprimento, alguns descrevem como alça eferente.

Imagem 5. Alças jejunais interposta e alimentar. Grampo metálico parcialmente exposto na luz, junto à anastomose gastrojejunal.
Gastrectomia Vertical
Na Gastrectomia Vertical (Sleeve) se confecciona um tubo gástrico vertical, através da ressecção da grande curvatura e do fundo gástrico, que se estende até o antro, próximo ao piloro.
Na avaliação endoscópica identifica-se estômago e junção esofagogástrica normais. Após a transição esofagogástrica, há um tubo longo paralelo à pequena curvatura que é o estômago tunelizado, de diâmetro variável, com expansão limitada pela linha de secção gástrica. É importante descrever o eixo da linha de sutura e a distância entre o final da linha de grampeamento e o piloro. A porção distal do segmento tubular é angulada para dificultar o esvaziamento gástrico. Após a angulação na incisura angularis, observam-se o piloro e duodeno que estão preservados.

Imagem 6. Remanescente gástrico com calibre reduzido, sendo evidenciada cicatriz de sutura longitudinal.
Banda Gástrica Ajustável
A técnica de colocação da Banda Gástrica Ajustável (BGA) se traduz na introdução de uma prótese de silicone por videolaparoscopia na porção alta do estômago, sendo o diâmetro interno da banda regulado por injeção de líquido no dispositivo, posicionado na parede abdominal, através de um mecanismo percutâneo de insuflação. O órgão ganha a configuração de uma ampulheta; é um método puramente restritivo, sem exclusão gástrica.
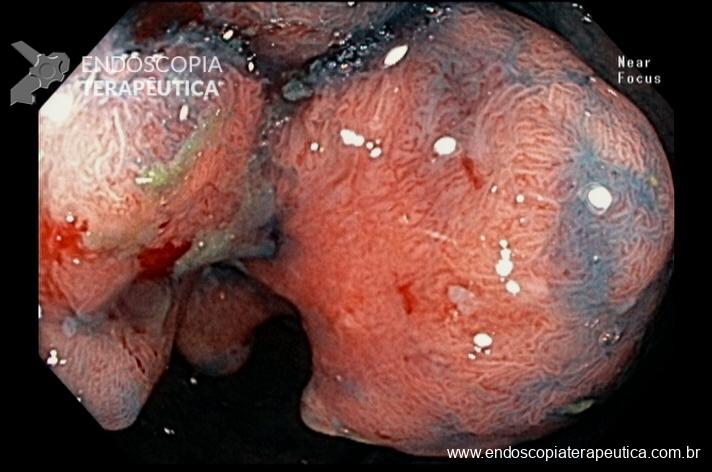
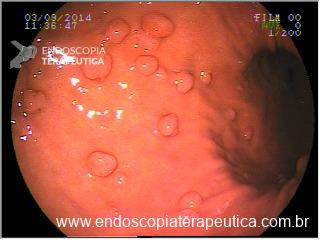
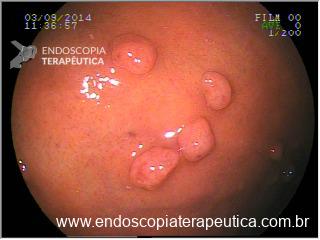
No exame endoscópico dos pacientes com BGA, identificam-se tipos variáveis de compressão extrínseca circunferencial na porção proximal do estômago. Instantes após a entrada do endoscópio no estômago, identifica-se a impressão anelar na mucosa gástrica, distando aproximadamente 3cm da linha Z, levando a formação de uma pequena bolsa. À manobra de retrovisão, nota-se a impressão anelar envolvendo uniformemente toda a circunferência do órgão. É importante medir o tamanho da bolsa e a distância da Linha Z até a impressão da banda, isto permite eventual diagnóstico de deslocamento da banda ou dilatação da bolsa.
Imagens 7 e 8 – Impressão de banda gástrica em visão do fundo gástrico em retroversão do endoscópio.
Gastroplastia Endoscópica
A Gastroplastia Endoscópica, também chamada de Endosutura Gástrica (ESG Endoscopic Sleeve Gastroplasty) não é uma intervenção cirúrgica. Através de um equipamento de sutura acoplado ao endoscópico são realizados pontos totais visando a aproximação de serosa com serosa no corpo gástrico e em alguns casos no fundo gástrico. Incialmente observamos a redução da luz, mas após alguns meses o resultado esperado são retrações cicatriciais e diminuição da distensibilidade do estômago.
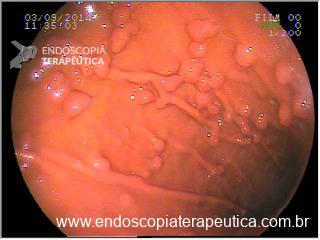
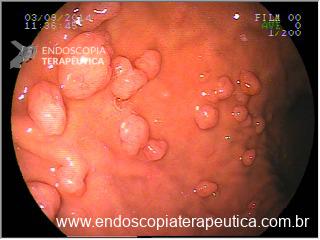
No exame endoscópico de pacientes submetidos à gastroplastia endoscópica notamos aderências entre pregas, retrações cicatriciais ou pontes de mucosa. O principal achado endoscópico que deve observado e descrito é distensibilidade gástrica diminuída à insuflação de ar. A presença de fios soltos é comum em pacientes com perda de peso sustentada. O emagrecimento e manutenção do peso se dá principalmente pela diminuição da complacência gástrica e provavelmente retardo do esvaziamento gástrico.

Imagem 9: Imagem endoscópica do equipamento de sutura Apollo Overstitch
Imagens 10 e 11: Corpo gástrico distal do mesmo paciente antes e imediatamente após a gastroplastia endoscópica.



Imagens 12, 13 e 14. Pontes de mucosa com retração cicatricial, fios de sutura, tubulização do corpo gástrico e distensibilidade diminuída à insuflação.
Confira também: Anatomia endoscópica pós cirurgia bariátrica
AUTORES
REFERÊNCIAS BILIOGRÁFICAS
- American Society for Gastrointestinal Endoscopy Standards of Practice Committee, Evans JA, Muthusamy VR, et al. The role of endoscopy in the bariatric surgery patient. Gastrointest Endosc 2015; 81:1063.
- Huang CS, Forse RA, Jacobson BC, Farraye FA. Endoscopic findings and their clinical correlations in patients with symptoms after gastric bypass surgery. Gastrointest Endosc 2003; 58:859.
- Obstein KL, Thompson CC. Endoscopy after bariatric surgery (with videos). Gastrointest Endosc 2009; 70:1161.
- Baker MT. The history and evolution of bariatric surgical procedures. Surg Clin North Am 2011: 91(6):1181-201
- Hedjoudje A, Dayyeh BA, Cheskin LJ, Adam A, Neto MG, Badurdeen D, Morales JG, Sartoretto A, Nava GL, Vargas E, Zhixian S, Fayad L, Farha J, Khashab MA, Kalloo AN, Alqahtani AR, Thompson C, Kumbhari V. Efficacy and Safety of Endoscopic Sleeve Gastroplasty: a Systematic Review and Meta-Analysis. Clin Gastroenterol Hepatol. 2019 Aug 20.
- Liu P, Zheng CZ. Long-term outcomes and a cause of high rate of loss to follow-up after laparoscopic adjustable gastric banding in obese patients. Zhonghua Wei Chang Wai Ke ZA Zhi 2013
- Dayyeh BK, Lautz DB, Thompson CC. Gastrojejunal stoma diameter predicts weight regain after Roux-en-Y gastric bypass. Clin Gastroenterol Hepatol. 2011
- Endoscopic sleeve gastroplasty: Case report, technique and literature review. Loo H, Chan WK, Galvao Neto M. J Dig Dis. 2017 ct;18(10):598-603.