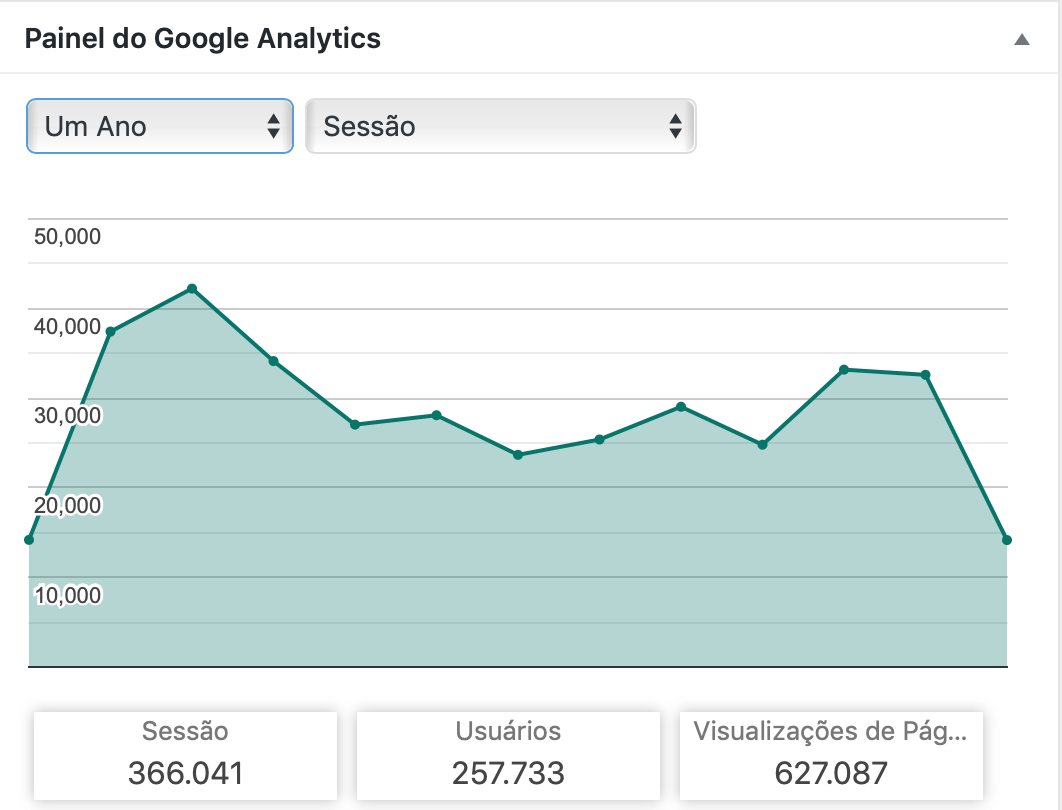
Depois de muitas tentativas de padronizar a classificação histológica das gastropatias, hoje ainda vemos divergências de opiniões. A classificação de Sydney atualizada tem se mostrado a mais reconhecida e amplamente utilizada na atualidade. Ela classifica as lesões em termos de morfologia, topografia e possíveis etiologias (aguda, crônica ou específica).
Gastropatia refere-se a dano e regeneração de células epiteliais, sem ou com mínimo processo inflamatório. Para avaliar a etiologia, uma história completa é necessária, avaliando o uso de medicamentos, histórico de cirurgias prévias e fatores de risco. As causas de maior destaque são:

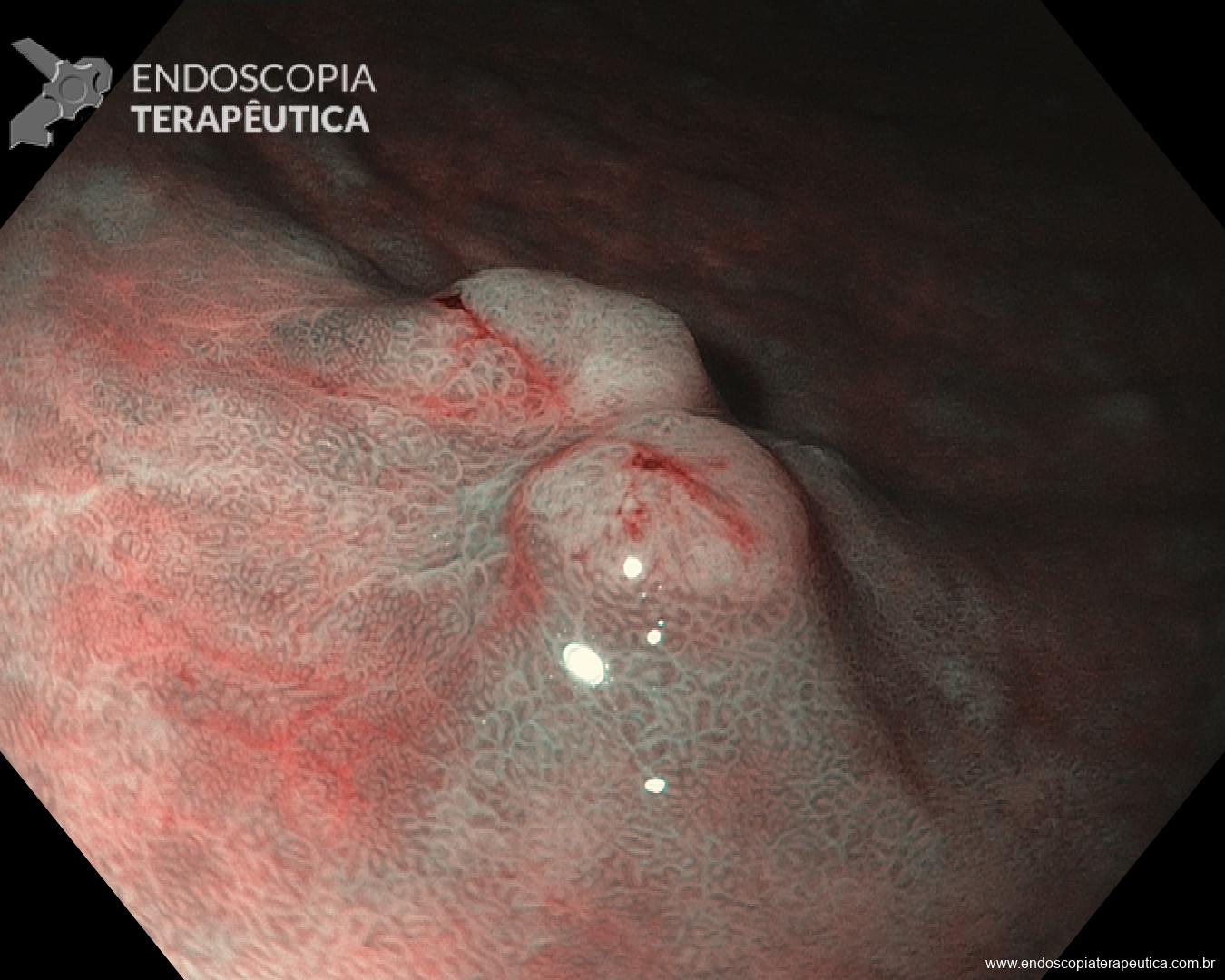
Gastropatias erosivas hemorrágicas agudas são caracterizadas por desenvolvimento de hemorragia e erosão após exposição da mucosa a algum agente agressor ou por baixa perfusão.
As lesões na superfície do epitélio costumam estar associadas a uma perda na barreira mucosa que pode ocorrer por dano direto: refluxo biliar, uso de AINE, abuso de álcool, alendronato, sais de ferro; por isquemia da mucosa com hipóxia do tecido: sepse, queimaduras, uso de cocaína, trauma ou pela associação das duas condições como em alguns agentes antineoplásicos. Nos casos de TCE pode ocorrer um aumento na produção de gastrina, o que aumentaria a secreção ácida causando lesão direta.
A ruptura da barreira de proteção gástrica permite que o fator agressor penetre até a lâmina própria causando danos a vasculatura, estimulando nervos, liberando histamina e outros mediadores inflamatórios. O dano tecidual aumenta após a reperfusão com liberação de radicais livres e infiltração de neutrófilos. Nos casos específicos de AINE o dano ainda é aumentado pela diminuição das prostaglandinas (que atuariam na estimulação da barreira protetora de muco e bicarbonato).
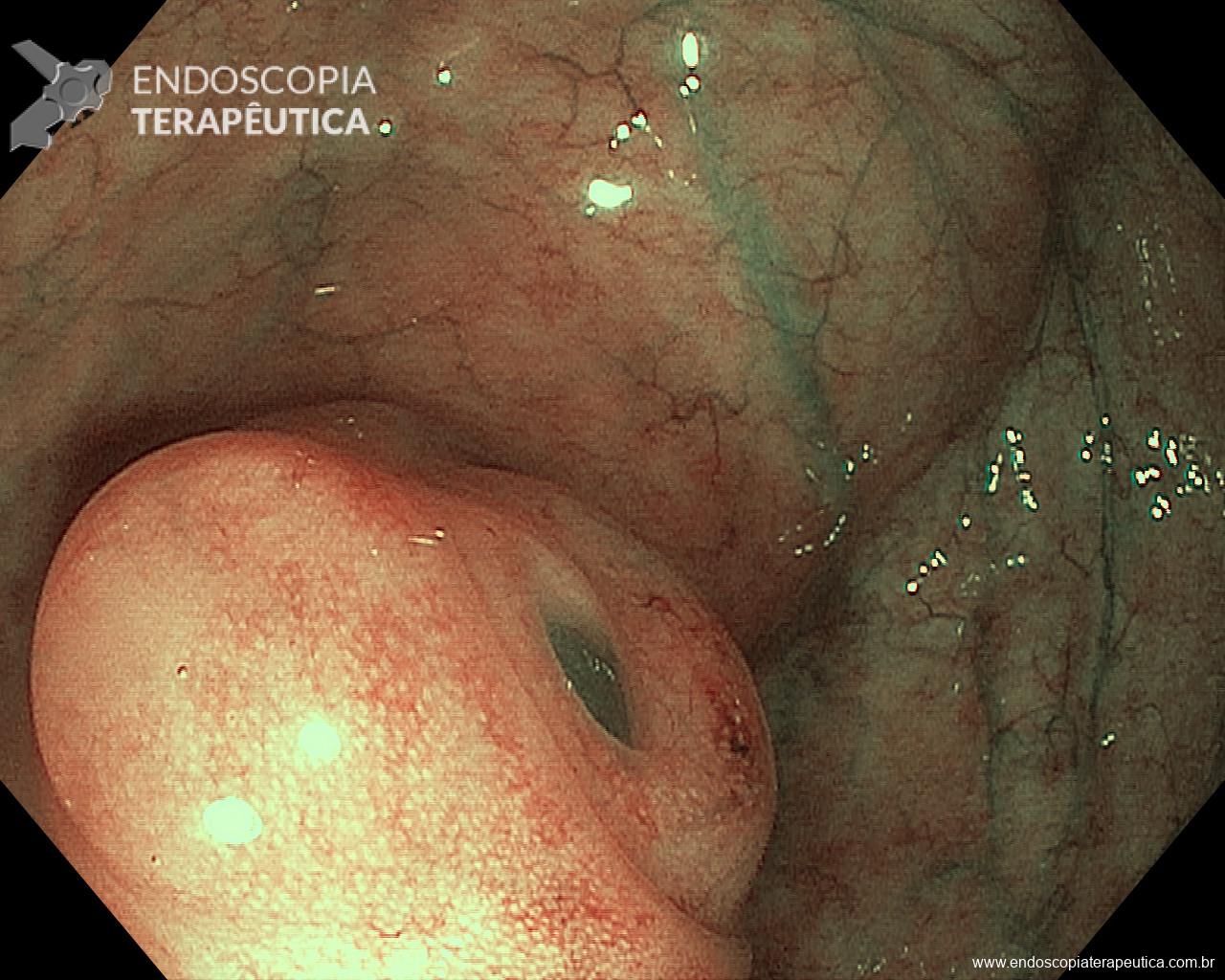
Clinicamente pode se apresentar como dor abdominal, pirose, náusea, vômito e hematêmese. O sangramento pode ocorrer de 3 a 10 dias do evento agressor e pode variar de sangue oculto nas fezes até a sangramento massivo. Na endoscopia pode se visualizar, geralmente, hemorragia petequial difusa e aparecimento de pequenas erosões vermelhas ou pretas.
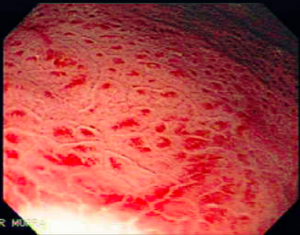
Úlceras de estresse usualmente ocorrem geralmente no corpo e fundo gástrico, próximo a transição esofagogástrica. Costumam ser múltiplas, rasas e o tamanha varia de 0,5 a 2cm de diâmetro.
As lesões por AINE e álcool envolvem todo o estômago desde o início, apesar das alterações ficarem mais evidentes em antro. As erosões nessas condições costumam ser mais facilmente reepitelizadas que nas gastropatias isquêmicas. Algumas outras condições tem suas particularidades como exposto na tabela.
O tratamento das gastropatias hemorrágicas erosivas agudas deve incluir o afastamento do fator agressor/ condição desencadeante; o uso de IBP e terapêutica específica para lesão focal.
GASTROPATIA REATIVA
A exposição por longos períodos a agentes agressores da mucosa pode levar a alterações da mesma (discreta inflamação, graus variados de hiperplasia foveolar, edema, proliferação de musculatura lisa da lâmina própria, congestão e dilatação vascular). O uso crônico de AINE, alendronato ou refluxo biliar são as principais causas desta condição.
-
Associada a Refluxo Biliar
Incompetência do piloro, motilidade duodenal alterada ou estoma podem acarretar refluxo biliar levando a dor abdominal, vômito bilioso e perda de peso; conhecido como gastropatia do refluxo biliar. Podem sofrer alterações adaptativas na maioria dos casos, porém em alguns casos pode acarretar erosões e úlceras. O tratamento definitivo geralmente é cirúrgico (revisão de Y de Roux), que melhora os sintomas em 50-90% dos casos.
O uso crônico de AINE obedece ao mesmo padrão de adaptabilidade na maior parte dos usuários, reduzindo o sangramento e as erosões; no entanto, quando ocorre falha na adaptação ao AINE o paciente pode apresentar sangramento por erosões ou úlceras. Essa falha costuma ser mais prevalente em pacientes com H. pylori.
VASCULAR
-
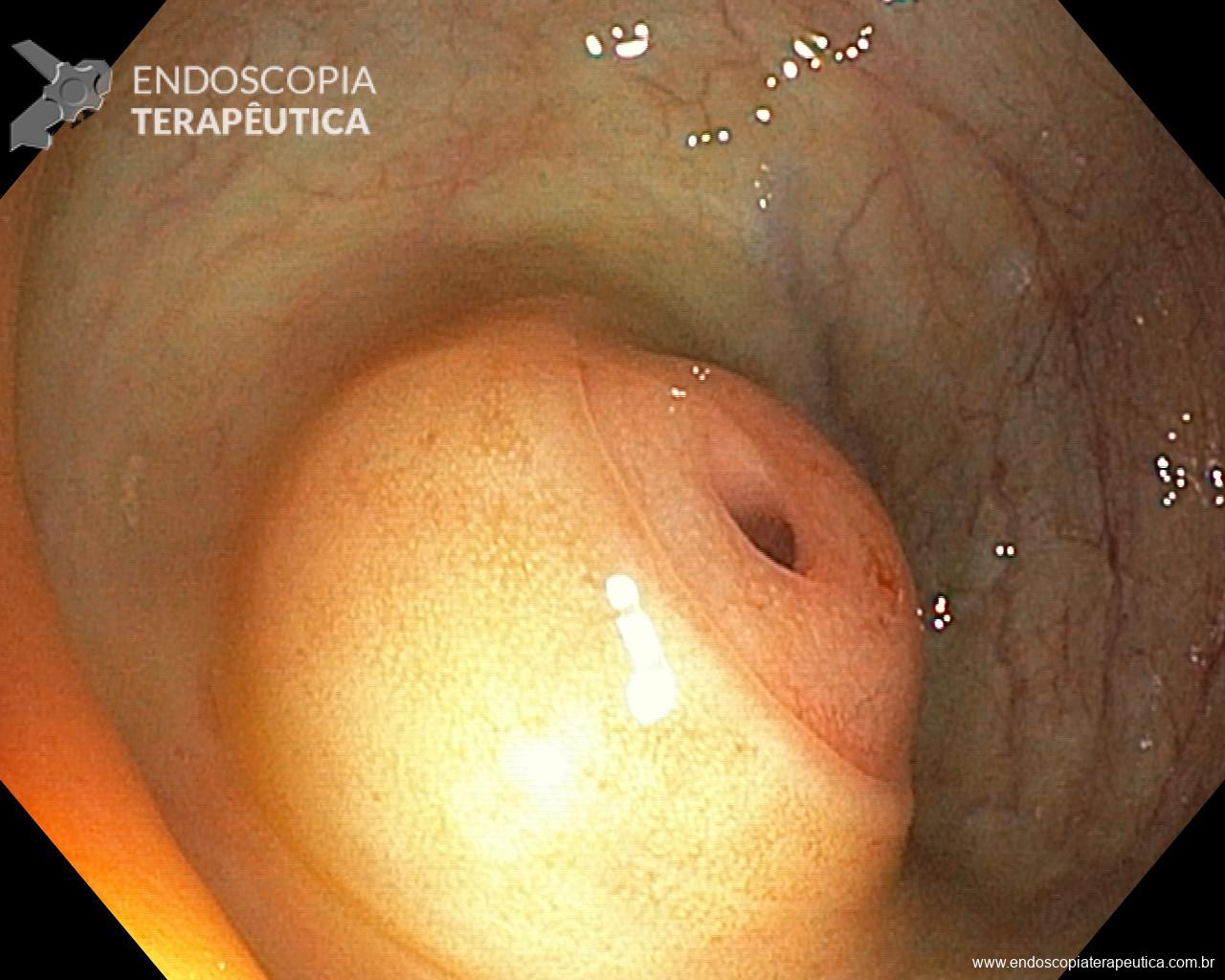
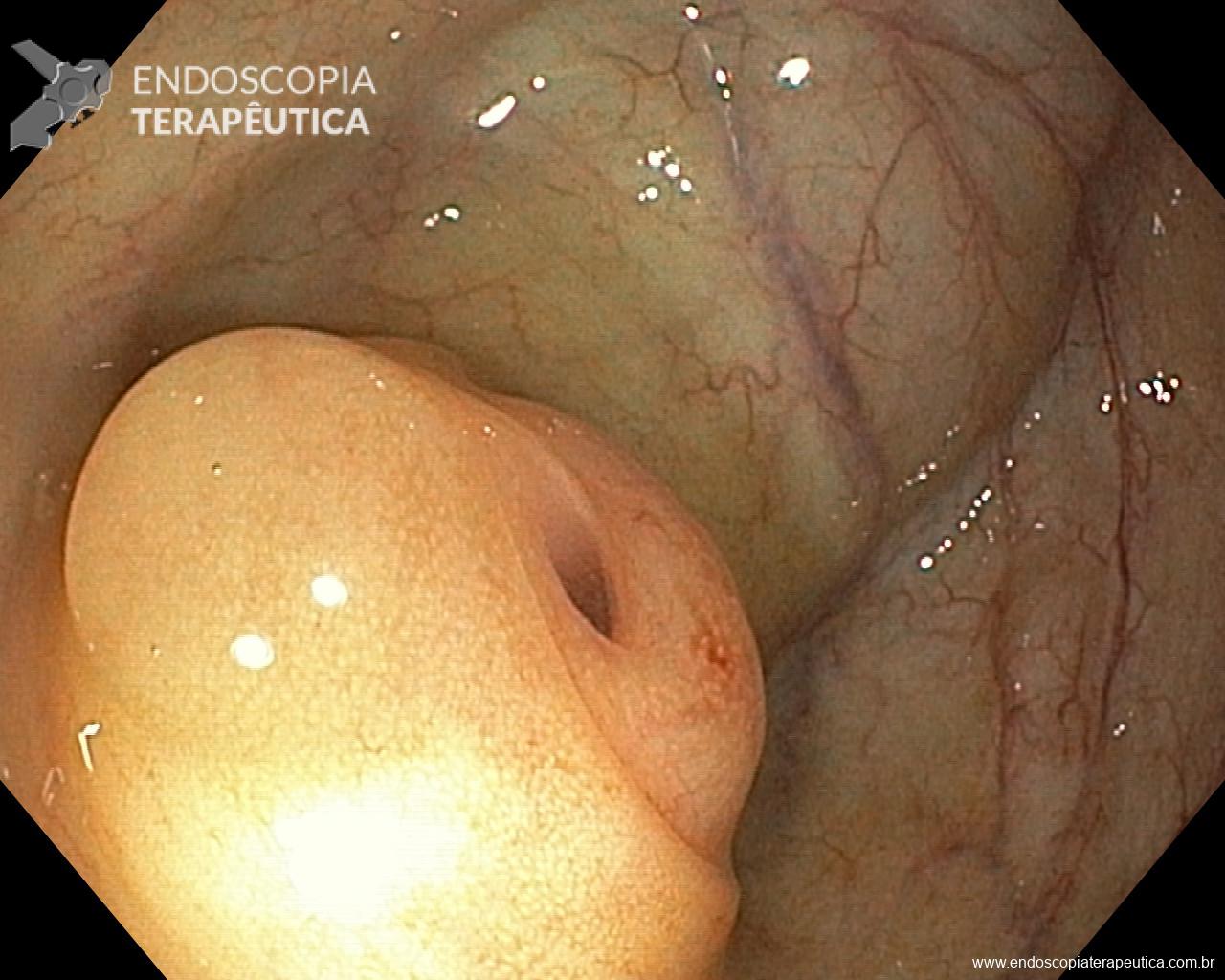
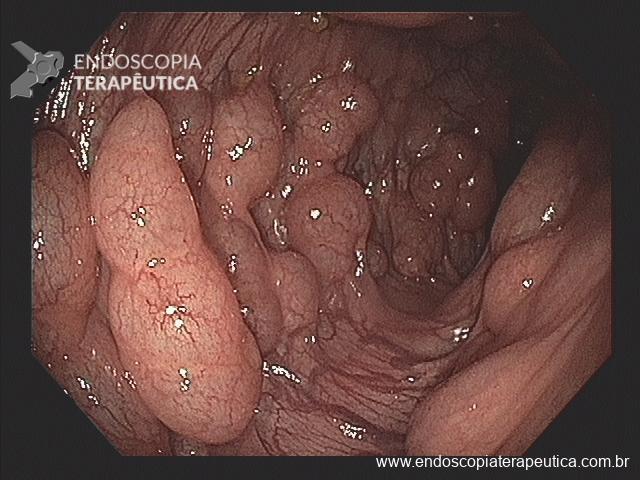
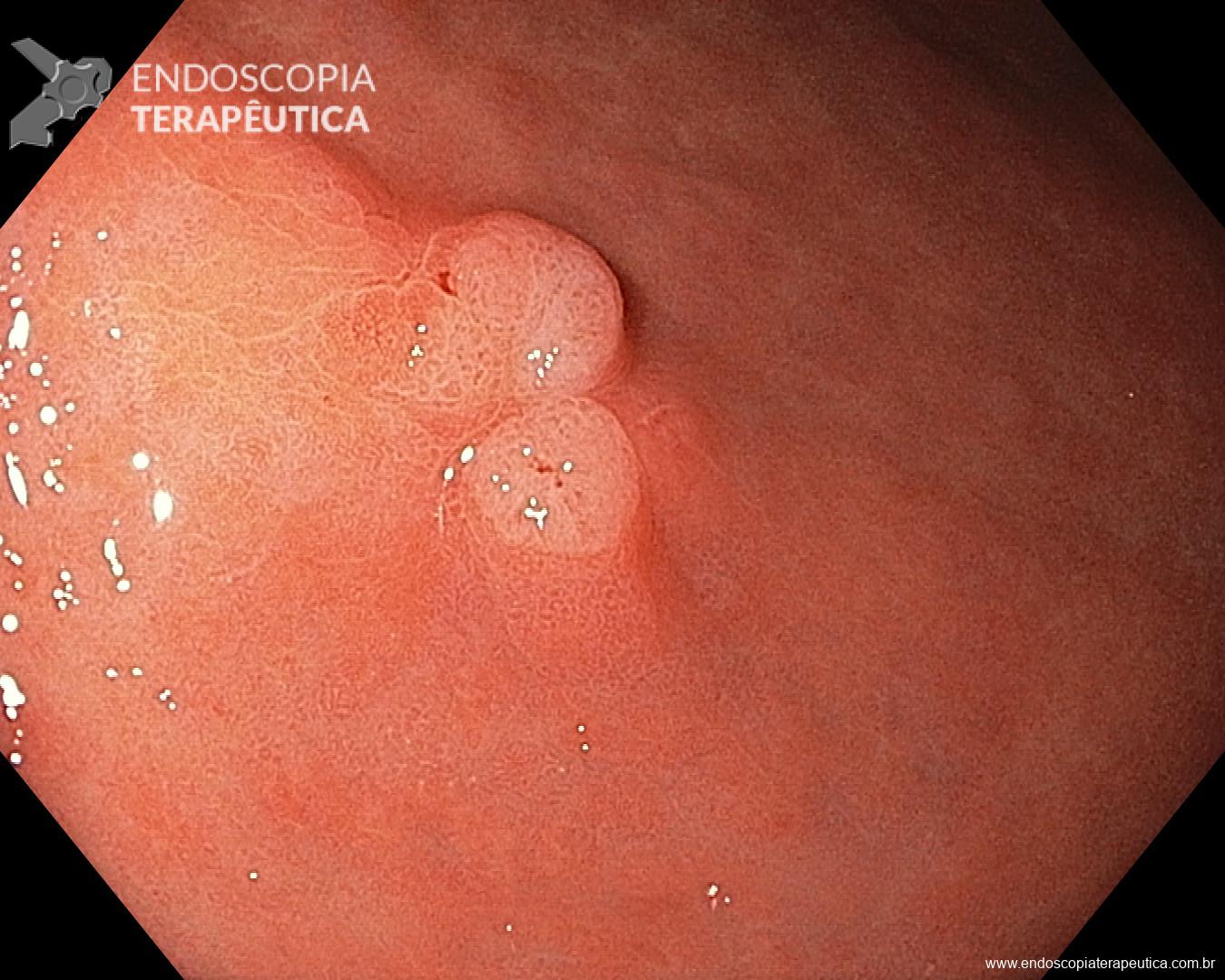
Gastropatia hipertensiva portal (GHP)
Ocorre geralmente associada a cirrose ou trombose de veia porta. A hipertensão portal nessas situações geram um aumento do fluxo sangüíneo que irrigam os vasos gástricos.
A gravidade da GHP está relacionada a pressão portal, o grau de resistência vascular hepática e o grau de redução da perfusão hepática. É comum que o diagnóstico da GHP ocorra durante endoscopia de rastreio para varizes de esôfago. No entanto pode ocorrer sangramento crônico em 3-60% dos casos e sangramento agudo em 2 -12%.
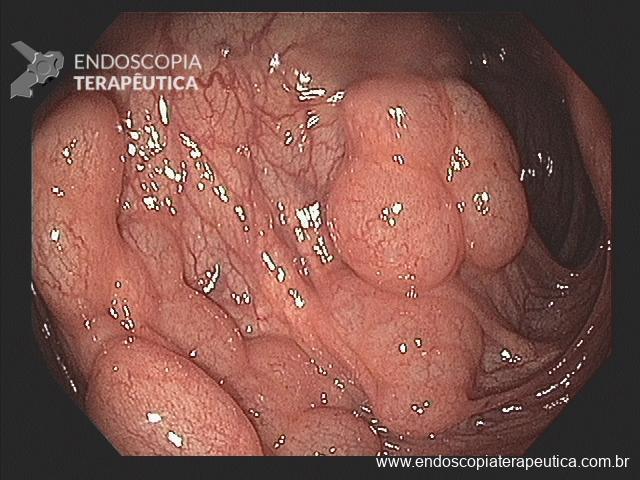
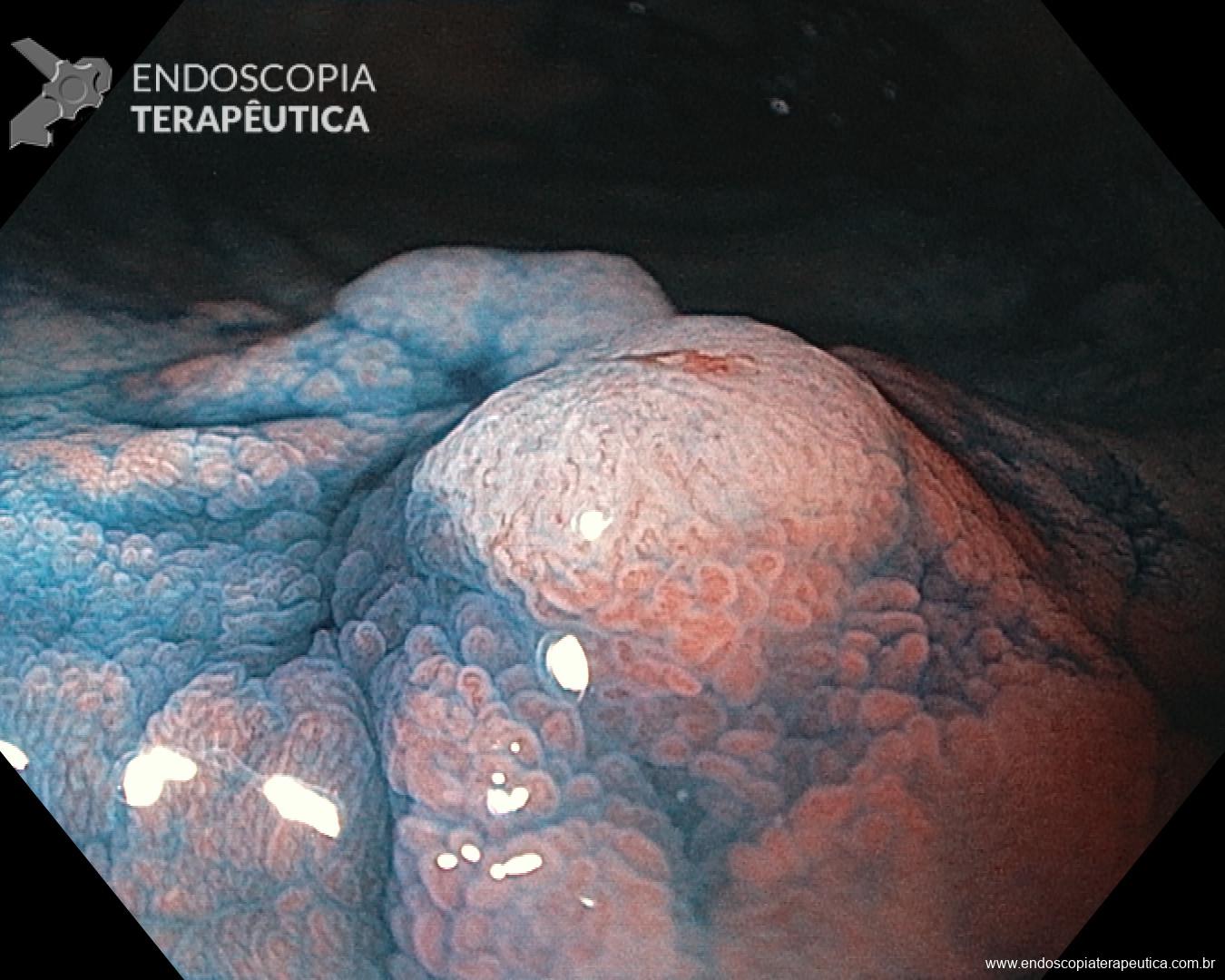
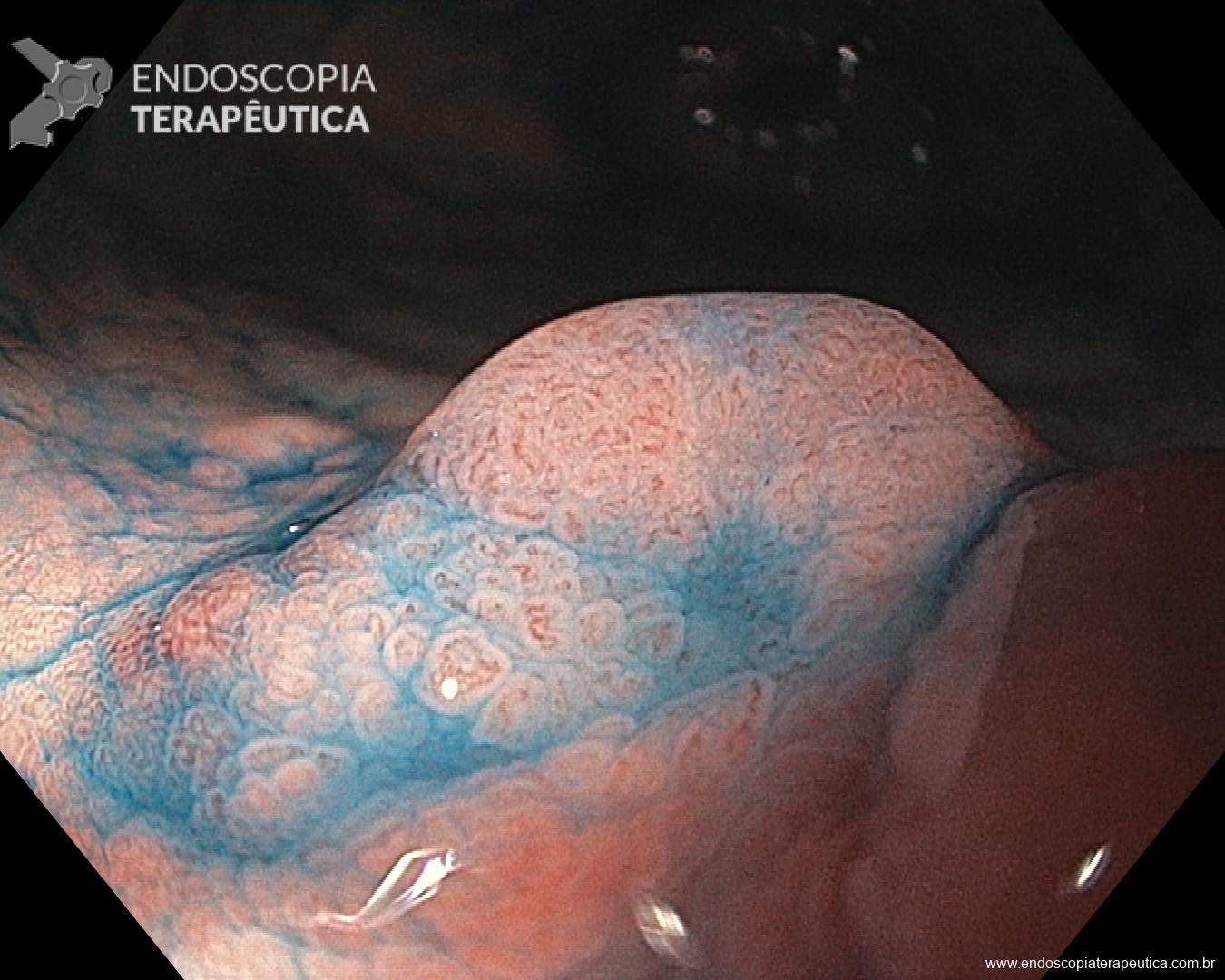
Os achados endoscópicos são caracterizados por enantema associado a fino rendilhado branco sobreposto dando a aparência de pele de cobra, pode também ocorrer red spots ou black/brown spots. Sua localização costuma ser em fundo e corpo proximal mas pode se estender para antro.
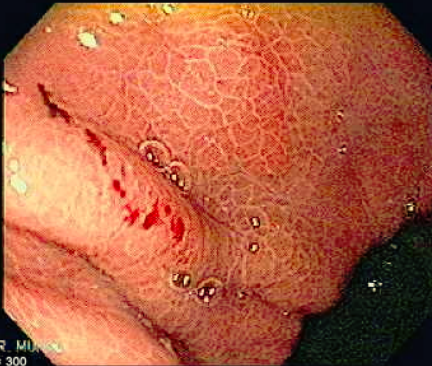
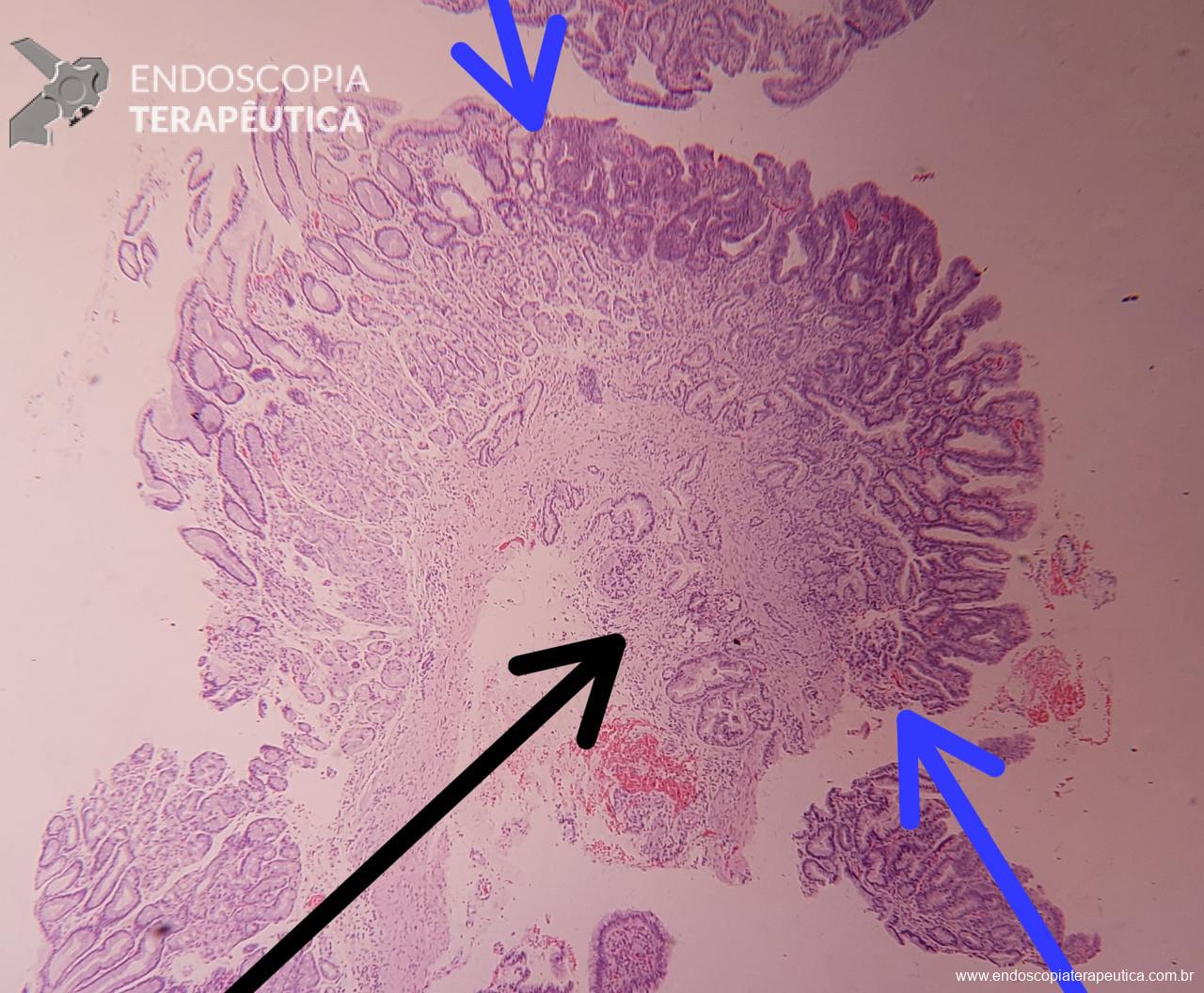
Casos de GHP leve podem mimetizar outras condições e então a realização de biópsias poderia ajudar no diagnóstico (sempre atentar a coagulopatia). Casos mais graves costumam cursar com hemorragias subepiteliais e aumento da vasculatura semelhante a angioma.
O tratamento na profilaxia primária consiste em beta bloqueador não seletivo para manter uma freqüência cardíaca (FC) em torno de 50-55 bpm. Em casos de sangramento crônico deve-se repor ferro e se houver uma queda de hemoglobina abaixo de 7 deve ser realizada transfusão.
Nos casos de sangramento agudo deve ser lançado mão de droga vasoativa (Octreotide por 2 dias, ou Somatostatina por 3 dias, ou Terlipressina 2-5 dias), ressuscitação volêmica, manter a hemoglobina entre 7-8 nos cirróticos, os portadores de cirrose também devem receber antibiótico profilaxia para PBE. Em pacientes refratários pode ser lançado mão de TIPS, shunt cirúrgico ou transplante hepático.
-
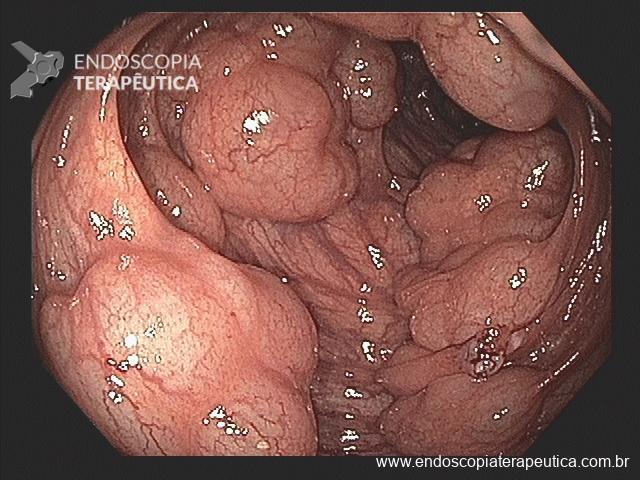
Ectasia vascular antral gástrica (GAVE)
Ocorre devido a dilatação de pequenos vasos da região antral. Na histologia nota-se ectasia vascular, além de trombos, proliferação celular e fibro-hialinização. Apresenta-se com enantema petequial e que por vezes podem ser lineares, podendo ter aparência de estômago em melancia.
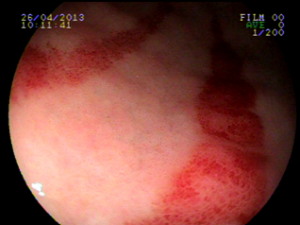
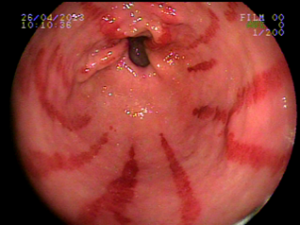
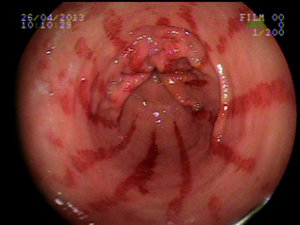
Apesar de sua etiologia não ser bem definida pode estar associada a cirrose, doenças autoimunes, insuficiência renal crônica, cardiopatia isquêmica ou transplante de medula óssea. Pode levar a anemia e raramente a hemorragia digestiva. O tratamento consiste na ablação das lesões com plasma de argônio ou heater probe.
Referências
1. Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol 1996; 20:1161.
2. Carpenter HA, Talley NJ. Gastroscopy is incomplete without biopsy: clinical relevance of distinguishing gastropathy from gastritis. Gastroenterology 1995; 108:917.
3. Marrone GC, Silen W. Pathogenesis, diagnosis and treatment of acute gastric mucosal lesions. Clin Gastroenterol 1984; 13:635.
4. Silen W. The clinical problem of stress ulcers. Clin Invest Med 1987; 10:270.
5. Franke A, Teyssen S, Singer MV. Alcohol-related diseases of the esophagus and stomach.
Dig Dis 2005; 23:204.
6. Kvietys PR, Twohig B, Danzell J, Specian RD. Ethanol-induced injury to the rat gastric mucosa. Role of neutrophils and xanthine oxidase-derived radicals. Gastroenterology 1990; 98:909.
7. Minalyan A, Gabrielyan L, Scott D, et al. The Gastric and Intestinal Microbiome: Role of Proton Pump Inhibitors. Curr Gastroenterol Rep 2017; 19:42.
8. Haig A, Driman DK. Iron-induced mucosal injury to the upper gastrointestinal tract. Histopathology 2006; 48:808.
9. Nam SY, Choi IJ, Park KW, et al. Risk of hemorrhagic gastropathy associated with colonoscopy bowel preparation using oral sodium phosphate solution. Endoscopy 2010; 42:109.
10. Petras RE, Hart WR, Bukowski RM. Gastric epithelial atypia associated with hepatic arterial infusion chemotherapy. Its distinction from early gastric carcinoma. Cancer 1985; 56:745.
11. Gourgoutis G, Das G. Gastrointestinal manifestations of cocaine addiction. Int J Clin Pharmacol Ther 1994; 32:136.
12. Dixon MF, O’Connor HJ, Axon AT, et al. Reflux gastritis: distinct histopathological entity? J Clin Pathol 1986; 39:524.
13. Sobala GM, King RF, Axon AT, Dixon MF. Reflux gastritis in the intact stomach. J Clin Pathol 1990; 43:303.
14. Graham DY, Malaty HM, Goodgame R. Primary amino-bisphosphonates: a new class of gastrotoxic drugs–comparison of alendronate and aspirin. Am J Gastroenterol 1997; 92:1322.
15. Weinstein WM, Buch KL, Elashoff J, et al. The histology of the stomach in symptomatic patients after gastric surgery: a model to assess selective patterns of gastric mucosal injury. Scand J Gastroenterol Suppl 1985; 109:77.
16. Shafique K, Araujo JL, Veluvolu R, et al. Mitochondrial Iron Accumulation in Parietal and Chief Cells in Iron Pill Gastritis Following Billroth II Gastrectomy: Case Report Including Electron Microscopic Examination. Ann Clin Lab Sci 2017; 47:354.
17. Cheli R, Giacosa A, Marenco G, et al. Chronic gastritis and alcohol. Z Gastroenterol 1981; 19:459.
18. Oddsson E, Binder V, Thorgeirsson T, et al. A prospective comparative study of clinical and pathological characteristics in Icelandic and Danish patients with gastric ulcer, duodenal ulcer, and X-ray negative dyspepsia. II. Histological results. Scand J Gastroenterol 1978; 13:489.
19. Uppal R, Lateef SK, Korsten MA, et al. Chronic alcoholic gastritis. Roles of alcohol and Helicobacter pylori. Arch Intern Med 1991; 151:760.
20. Roth SH, Bennett RE. Nonsteroidal anti-inflammatory drug gastropathy. Recognition and
response. Arch Intern Med 1987; 147:2093.
21. Shorrock CJ, Rees WD. Mucosal adaptation to indomethacin induced gastric damage in man–studies on morphology, blood flow, and prostaglandin E2 metabolism. Gut 1992; 33:164.
22. Konturek SJ, Brzozowski T, Majka J, et al. Adaptation of the gastric mucosa to stress. Role of prostaglandin and epidermal growth factor. Scand J Gastroenterol Suppl 1992; 193:39.
23. Silvoso GR, Ivey KJ, Butt JH, et al. Incidence of gastric lesions in patients with rheumatic disease on chronic aspirin therapy. Ann Intern Med 1979; 91:517.
24. Larkai EN, Smith JL, Lidsky MD, Graham DY. Gastroduodenal mucosa and dyspeptic symptoms in arthritic patients during chronic nonsteroidal anti-inflammatory drug use. Am J Gastroenterol 1987; 82:1153.
25. Davenport HW. Salicylate damage to the gastric mucosal barrier. N Engl J Med 1967; 276:1307.
26. Sloan JM. Acute haemorrhage gastritis and acute infective gastritis, gastritis caused by physi cal agents and corrosives, uraemic gastritis. In: Gastrointestinal and Oesophageal Patholog y, Whitehead R (Ed), Churchill Livingstone, Edinburgh 1989. p.385.
27. Hernandez LA, Grisham MB, Twohig B, et al. Role of neutrophils in ischemia-reperfusion- induced microvascular injury. Am J Physiol 1987; 253:H699.
Confira também: H. pylori