Manejo e Tratamento da Hemorragia Digestiva Baixa Aguda
Hemorragia digestiva é a principal causa de hospitalização devido a doenças do trato gastrointestinal nos Estados Unidos, sendo 30 a 40% dos casos devido a hemorragia digestiva baixa (HDB). Na maioria dos pacientes, a HDB aguda é resolvida de forma espontânea, sem necessidade de intervenção e sem complicações. Entretanto, a idade avançada e a presença de múltiplas comorbidades estão relacionadas com o aumento da morbi-mortalidade neste grupo de pacientes.
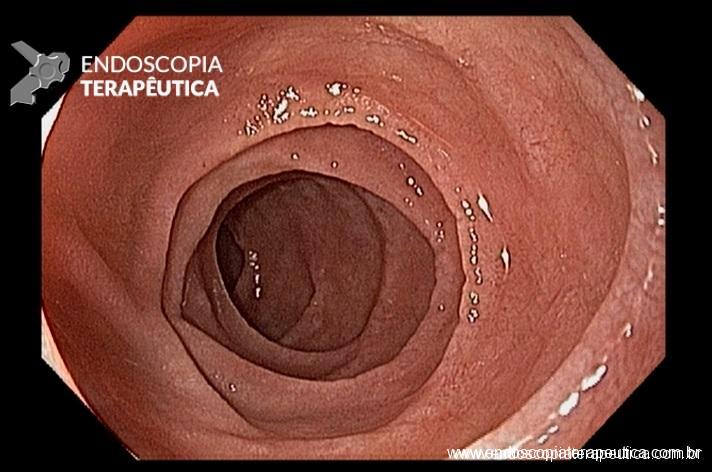
Classicamente, a HDB aguda manifesta-se com hematoquezia (sangue vermelho vivo ou marrom pelo reto). Porém, raramente, pode manifestar-se também com melena.
Anteriormente, a HDB era definida como hemorragia originada distalmente ao ângulo de Treitz. Atualmente, com a definição de hemorragia digestiva média, a HDB é definida como sangramento originado do cólon e do reto.
- Hemorragia Digestiva Alta: Sangramento que ocorre até o ângulo de Treitz
- Hemorragia Digestiva Média: Sangramento originado entre o ângulo de Treitz e a válvula ileocecal
- Hemorragia Digestiva Baixa: Sangramento originado do cólon e do reto
Etiologia:
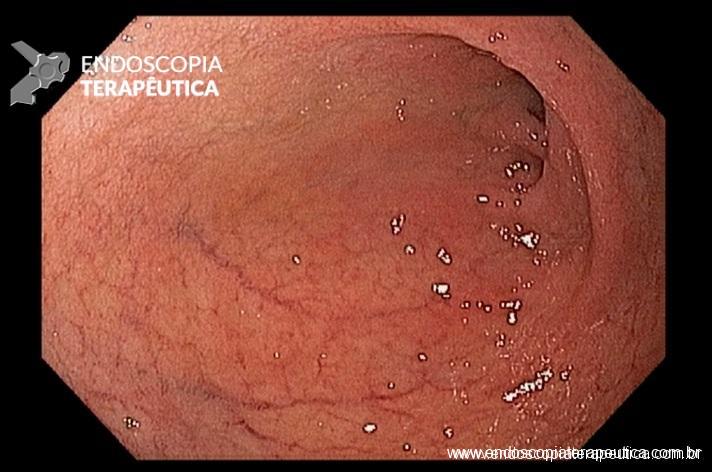
As causas de HDB incluem: doença diverticular (30-65%), colite isquêmica (5-20%); doença hemorroidária (5-20%), pólipos ou neoplasias colorretais (2-15%), angiectasias (5-10%), sangramento pós-polipectomia (2-7%), doença inflamatória intestinal (3-5%), colite infecciosa (2-5%), úlcera retal solitária (0-5%), varizes colorretais (0-3%), proctopatia actínica (0-2%), colopatia induzida por AINEs (0-2%), lesão de Dieulafoy (raro);
É importante atentar para situações em que o paciente apresenta hematoquezia com instabilidade hemodinâmica: pode representar um sangramento digestivo alto. Nestes casos, deve-se considerar a realização de endoscopia digestiva alta e esta deve ser realizada imediatamente antes da colonoscopia;
Manejo inicial:
O manejo não é distinto da hemorragia digestiva de qualquer topografia e/ou etiologia: anamnese direcionada à investigação da etiologia, exame físico detalhado (inclusive com toque retal) e avaliação laboratorial devem ser realizados assim que o paciente se apresentar. A ressuscitação hemodinâmica também deve ser efetuada de imediato.
Deve-se atentar para presença de comorbidades (que podem mudar o desfecho) e uso de medicações como AINEs, antiagregantes e anticoagulantes. Entre os fatores de risco para desfechos adversos (ressangramento, necessidade de intervenção e óbito) incluem: hipotensão, taquicardia, vigência de sangramento ativo, idade maior que 60 anos, creatinina maior que 1,7 mg/dl e instabilidade ou presença de várias dessas condições;
Atentar para a necessidade de transfusão sanguínea: os guidelines recentes recomendam transfusão com o intuito de manter a hemoglobina acima de 7g/dl na maioria dos pacientes e, em pacientes com comorbidades clinicamente significantes (especialmente isquemia miocárdica), em torno de 9 g/dl.
Investigação diagnóstica:
1. Colonoscopia
- A colonoscopia é o procedimento inicial para quase todos os pacientes que se apresentam com HDB aguda – é diagnóstica e também terapêutica, se houver necessidade;
- O guideline do Colégio Americano de Gastroenterologia sugere que a colonoscopia deve ser a modalidade diagnóstica de primeira linha para avaliação e tratamento da HDB;
- Estudos indicam que a colonoscopia identifica de forma definitiva o sítio de sangramento em 45 – 90% dos pacientes.
A colonoscopia deve ser realizada nas primeiras 24 horas da chegada do paciente, após estabilização hemodinâmica e preparo adequado do cólon;
Estudos observacionais têm demonstrado uma alta frequência de definição diagnóstica e baixo tempo de internação em pacientes com HDB submetidos a colonoscopia precoce (entre 12 e 24 horas após a entrada) em comparação com pacientes submetidos a colonoscopia tardia, embora dois estudos randomizados pequenos comparando colonoscopia precoce com tardia não tenham mostrado diferença significativa no tempo de internação, ressangramento ou necessidade de cirurgia;
- O preparo do cólon é essencial para a adequada visualização endoscópica, diagnóstico e tratamento. Colonoscopia ou retossigmoidoscopia sem preparo adequado geralmente não são realizadas, entretanto podem ser consideradas em casos selecionados (por exemplo, suspeita de sangramento do cólon esquerdo distal) com limpeza e inspeção cuidadosas do cólon durante do procedimento;
- Em pacientes com preparo do cólon inadequado, a sensibilidade cai significativamente e o sucesso do tratamento é obtido em menos de 21% dos pacientes;
- Em pacientes em vigência de sangramento sem condições de ingesta oral do preparo, a passagem de sonda nasogástrica deve ser considerada se o risco de aspiração for baixo. Os pacientes devem evitar alimentos sólidos pelo menos 8 horas antes do procedimento. Líquidos claros, inclusive o preparo para colonoscopia, são permitidos até 2 horas antes do procedimento;
2. Exames de imagem
2.1. Cintilografia com hemácias marcadas
- Pode identificar sangramento com o fluxo muito baixo (0,1 ml/ minuto),
- Sua utilidade é controversa: um estudo retrospectivo sugere que a realização da cintilografia antes da angiografia está associada a um alto rendimento diagnóstico da angiografia quando comparado a angiografia sem cintilografia e permite o uso do contraste de forma mais seletiva.
- Entretanto outros estudos não confirmaram estes achados e tem sugerido maior utilidade da angioTC.
2.2. AngioTC
- Detecta sangramentos com fluxo de 0,3 ml/minuto,
- Alta acurácia na localização do sítio de sangramento (próximo a 100%)
- Pode ser usada imediatamente antes da angiografia para guiar a injeção de contraste de forma seletiva ou superseletiva.
- Seu principal problema é a necessidade de injeção de contraste intravenoso, com seu risco associado de nefrotoxicidade;
2.3 Angiografia
- Deve ser realizada assim que possível para realizar com precisão a localização do sangramento, seguida de sua terapêutica, visto que a HDB aguda é intermitente por natureza;
- De acordo com o Colégio Americano de Radiologia, a colonoscopia deve ser realizada nos pacientes estáveis hemodinamicamente que fizeram o preparo adequado e a angiografia em pacientes instáveis hemodinamicamente, em vigência de sangramento ativo.
Terapêutica
Endoscópica
Métodos endoscópicos de hemostasia incluem métodos de injeção, métodos térmicos (eletrocoagulação bipolar, heater probe e coagulação com plasma de argônio) e terapia mecânica (clipes e ligadura elástica);
O uso do método de injeção (solução de adrenalina 1:10.000 ou 1:20.000) facilita a hemostasia primária em sangramento agudo, mas deve ser realizada sempre em combinação com um segundo método (mecânico ou térmico) para alcançar a hemostasia definitiva;
A escolha do método é geralmente guiada pela causa e localização do sangramento, a habilidade para acessar o sítio e a experiência do endoscopista;
Diverticulose, angiectasia e sangramento pós-polipectomia são as fontes de sangramento que provavelmente mais se beneficiam da terapêutica endoscópica;
Os guidelines recomendam que o sangramento diverticular deve ser tratado endoscopicamente se houver estigmas de sangramento recente (sangramento ativo, vaso visível ou coágulo aderido). A terapia mecânica com uso de clipes é o método de escolha por teoricamente diminuir o risco de lesão transmural;
- Angiectasias colônicas, inclusive a proctopatia actínica, são comuns em idosos e embora manifestem-se com sangramento leve, pode ocorrer hematoquezia grave especialmente em pacientes em uso de antitrombóticos. O tratamento de escolha para essas lesões é a coagulação com plasma de argônio;
- A abordagem endoscópica para tratamento de sangramento pós-polipectomia inclui o uso de métodos mecânicos e térmicos, com ou sem injeção de solução de adrenalina prévia;
- Sangramentos secundários a colite isquêmica, doença inflamatória intestinal ou neoplasias colorretais geralmente não são passíveis de tratamento endoscópico e são normalmente tratados com suporte clínico, cirurgia ou ambos;
Em pacientes com recorrência do sangramento, deve-se repetir a colonoscopia, com hemostasia endoscópica se houver necessidade;
Endovascular
A angiografia permite tanto identificar o sítio de sangramento quanto a intervenção terapêutica. Entretanto, ela pode ser negativa quando o sangramento tem fluxo baixo (menor que 0,5ml/minuto) ou intermitente;
Série de casos mostra alto índice de sucesso em embolização (ausência de extravasamento de contraste) na HDB (73 a 100%). O índice de sucesso clínico (cessação do sangramento) varia de 63 a 96%, com taxa de ressangramento de 11 a 50%.
Cirurgia
A avaliação cirúrgica é indicada em caso de falha do tratamento endoscópico e vascular;
A localização do sítio de sangramento é essencial antes da ressecção cirúrgica para evitar a necessidade de colectomia subtotal e prevenir o ressangramento após a cirurgia, o que indica que a localização da lesão foi incorreta;
HDB e agentes antiplaquetários
O uso de agentes antiplaquetários aumentam o risco de sangramento gastrointestinal inferior, sendo o risco de sangramento baixo três vezes maior que o alto;
- Uma coorte retrospectiva envolvendo pacientes com HDB mostrou que aqueles que continuaram o uso de aspirina após o sangramento tiveram significativo aumento da recorrência de sangramento em 5 anos que aqueles que descontinuaram o uso (19,9% x 6,9%), entretanto tiveram baixo risco de eventos cardiovasculares sérios e morte. Para minimizar o risco de eventos cardiovasculares, a aspirina como profilaxia secundária não deve ser interrompida em pacientes com HDB. Entretanto, tem sido mostrado que baixas doses de aspirina como profilaxia primária oferece uma redução limitada no risco absoluto de eventos cardiovasculares sérios e morte e, em geral, devem ser evitadas em pessoas com HDB;
- Há falta de dados para guiar o cuidado com os pacientes que têm HDB em vigência de dupla antiagregação plaquetária. Pacientes submetidos a angioplastia com stent nos últimos 30 dias ou que tenham tido síndrome coronariana aguda (SCA) nos últimos 90 dias têm alto risco para infarto agudo do miocárdio e morte após descontinuarem o uso da dupla antiagregação e portanto são normalmente orientados a manter o uso das medicações;
- Naqueles pacientes em uso de stent ou com SCA há mais tempo, a descontinuação do segundo agente antiplaquetário é recomendada de 1 a 7 dias, pois a descontinuação desse segundo agente parece estar associada com um relativo baixo risco se o uso da aspirina for mantido.
Conclusão e recomendações
- Os pacientes que apresentam HDB devem ser submetidos a colonoscopia dentro das primeiras 24 horas, após estabilidade hemodinâmica e preparo adequado do cólon;
- Se sangramento volumoso e/ou instabilidade hemodinâmica, endoscopia digestiva alta deve ser realizada imediatamente antes da colonoscopia;
- A causa mais comum de HDB é a diverticulose (30-65%);
- A HDB tem resolução espontânea na maioria das vezes (70 a 80% em doença diverticular);
- Hemostasia endoscópica deve ser realizada quando a lesão for identificada com sangramento ativo ou sinais de sangramento recente (vaso visível e coágulo aderido);
- Em pacientes em vigência de sangramento ou sem resposta à ressuscitação hemodinâmica e que não podem ser submetidos à colonoscopia, deve ser realizada angioTC seguida de angiografia com embolização se houver indicação;
- A interrupção do uso de antiagregantes plaquetarios deve ser individualizada.
Referências:
- Acute Lower Gastrointestinal Bleeding. N Engl J Med 2017; 376: 1054-63;
- Diagnosis of Gastrointestinal Bleeding: A practical guide for clinicians. World J Gastrointest Pathophysiol. Nov 15, 2014; 5(4): 467-478
…………………………………………………………………………………………………………..
Como citar esse artigo:
Arraes L. Manejo e Tratamento da Hemorragia Digestiva Baixa Aguda. Endoscopia Terapêutica; 2018. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/hemorragia-digestiva-baixa-aguda
…………………………………………………………………………………………………………..
Leia mais sobre Hemorragia Digestiva Baixa:
– DIRETRIZES – ACG Clinical Guideline: Diagnosis and Management of Small Bowel Bleeding https://endoscopiaterapeutica.net/pt/diretriz/diretrizes-acg-clinical-guideline-diagnosis-and-management-of-small-bowel-bleeding/
– DIRETRIZES – Papel da endoscopia no paciente com sangramento gastrointestinal baixo https://endoscopiaterapeutica.net/pt/diretriz/diretrizes-papel-da-endoscopia-no-paciente-com-sangramento-gastrointestinal-baixo/
Aproveite e acesse o site Gastropedia clicando aqui para saber mais sobre este tema!
Confira também: Hemorragia digestiva média
Artigos comentados – Maio 2018 : Stents metálicos autoexpansíveis
Stents metálicos autoexpansíveis em estenoses biliares malignas.
Qual a melhor opção em próteses metálicas para drenagem de vias biliares ? Qual tem menos tendência a complicações ?
Há muito tempo discute em congressos e corredores o tema, em geral, com tendência a defender experiências locais e tomar decisões baseadas em efeitos colaterais vivenciados.
Assim, para esta postagem, foram selecionados dois artigos recentes da Gastrointestinal Endoscopy trazendo mais conhecimento sobre o assunto:
Trata-se de coorte retrospectiva em único centro com duração de 8 anos, concluída em 2016, avaliando pacientes com icterícia obstrutiva de origem neoplásica tratados com próteses metálicas autoexpansíveis. Foram avaliados 645 pacientes, dos quais 431 (66,8%) com próteses metálicas não recobertas (U-SEMS) e 214 totalmente cobertas (FC-SEMS) (33,2%). A taxa de sobrevida (cerca de 160 dias), sucesso técnico, sucesso clínico, patência (cerca de 550 dias) foram semelhantes nos dois grupos, assim como a taxa de colangite.
Lesões hilares foram mais propensas a oclusão, sendo o uso de AAS um fator protetor, provavelmente devido a redução da produção biliar de mucina, reduzindo a viscosidade da bile (descrito em estudo prévio dos mesmos autores).
Colecistite: 457 pacientes possuíam vesícula no momento da colocação da prótese, sendo evidenciada taxa global de 3,1% de colecistite. O grupo de pacientes com próteses totalmente cobertas teve maior taxa de colecistite (7,8%) do que o grupo de próteses não cobertas (1,2%), com significância estatística. Colelitíase não foi identificada como fator determinante para desenvolvimento de colecistite.
Migração: a taxa de migração foi de 10,7% no grupo de próteses totalmente recobertas e de 1,4% para próteses não recobertas (p>0,001). Lesões hilares foram identificadas como fator de risco para migração.
2. Self-expandable metal stents in malignant biliary obstruction: back to the roots with uncovered stents as “new” standart?. Editorial da Gastrointestinal Endoscopy Abril, 2018.
Trata-se de Editorial publicado na GIE, com foco no tipo de prótese a ser utilizado em estenoses biliares malignas, citando o artigo de Jang et al além de vários estudos tipo RCT e meta-análises .
O estudo de Jang et al. citado neste post é comentado no editorial, destacando a superioridade na taxa de colecistite das próteses cobertas (7,8%) em relação às não cobertas (1,2%) e maior taxa de migração das próteses totalmente cobertas. Ressalta-se que o estudo é retrospectivo. Comparando-o a outro estudo de mesma natureza, envolvendo 749 pacientes, não foi observada diferença na patência dos stents e taxa de sobrevida dos pacientes. Neste, a taxa global de colecistite foi de 0,5%, com pacientes de próteses não cobertas. A taxa de pancreatite foi maior para próteses cobertas (2,7%) do que não cobertas (1%) que embora tenha significância estatística não possui relevância clínica.
Meta-análise envolvendo 1057 pacientes de um total de 6 artigos tipo ensaio clínico randomizado, e dois retrospectivos evidenciou que não houve diferença no tempo de patência da prótese ou sobrevida do paciente com os diferentes modelos (coberto vs não coberto). Também não foi observada diferença na taxa de pancreatite ou colecistite de acordo com o tipo de prótese utilizada, contrastando com os dois estudos retrospectivos anteriores.
Outra meta-análise citada envolve 1417 pacientes oriundos de 14 artigos. Nesta, evidencia-se que próteses totalmente cobertas possuem risco relativo maior para formação de lama/lodo biliar (2,47), migração (9,33) e tumor “overgrowth” (1,76) quando comparado à próteses não cobertas. Por outro lado, prótese não cobertas possuem risco relativo para tumor “ingrowth” (0,25). No geral, apesar das diferenças citadas, a taxa de patência e disfunção da prótese foram semelhantes em ambos grupos, assim como taxa de colecistite e pancreatite.
Prótese parcialmente recobertas foram desenvolvidas para via biliar porém os resultados de um estudo retrospectivo recente não evidenciou diferença tanto na patência quanto taxa de migração quando comparado a outras próteses metálicas autoexpansíveis.
Considerações:
Não há mais discussão sobre a vantagem das próteses metálicas autoexpansíveis em relação às próteses plásticas para tratamento de estenoses malignas. Ressalto que na prática clínica, em muitos centros, ainda pode ser observada dificuldades em obter próteses metálicas, principalmente em casos de pacientes que abrem o quadro com colangite, pela ausência deste modelo de prótese no estoque dos hospitais. Muitas vezes são passadas próteses plásticas e posterior troca por próteses metálicas.
O melhor tipo de prótese metálica a ser empregado em estenoses biliares malignas ainda é controverso e seguirá sendo tema de congresso por muitos anos. A principal informação que ambos trabalhos trazem, é de que tanto próteses totalmente cobertas quanto próteses não cobertas possuem sucesso técnico, sucesso clínico, taxa de patência, taxa de colecistite, taxa de pancreatite e sobrevida geral semelhantes. Não importa muito que um modelo tenha maior obstrução por tumor overgrowth enquanto o outro tenha por ingrowth, o que interessa é a manutenção da patência da prótese por tempo semelhante.
As considerações feitas no final do editorial resumem bem a idéia de que a prótese deve ser escolhida baseada no padrão do paciente e não em guidelines. Há uma sugestão para utilização de prótese totalmente recobertas para pacientes com expectativa de vida mais longa, aptos para terapêutica adjuvante onde a troca de prótese é mais factível que tentativas de tunelização ou tratamento cirúrgico, onde a remoção dos modelos totalmente cobertos é mais fácil.
Qual sua experiência : Vivenciou algum dos eventos adversos relatados ? Use o espaço abaixo e discuta com outros especialistas sobre o assunto.
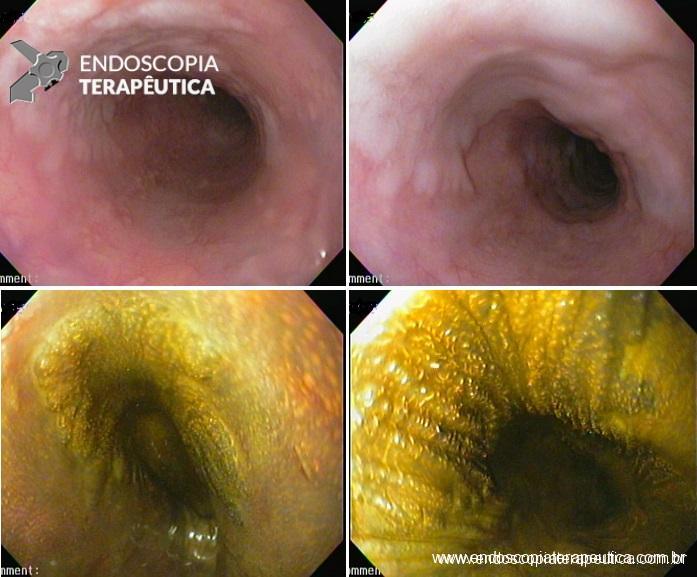
Esôfago negro
Esôfago proximal
Esôfago proximal/médio
Esôfago médio
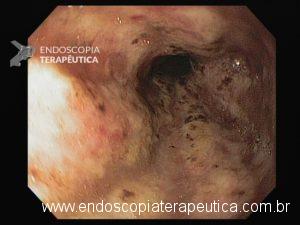
Esôfago distal
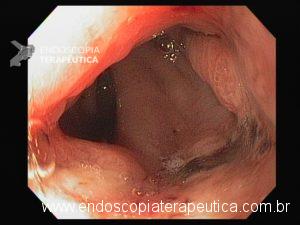
Esôfago distal
INTRODUÇÃO
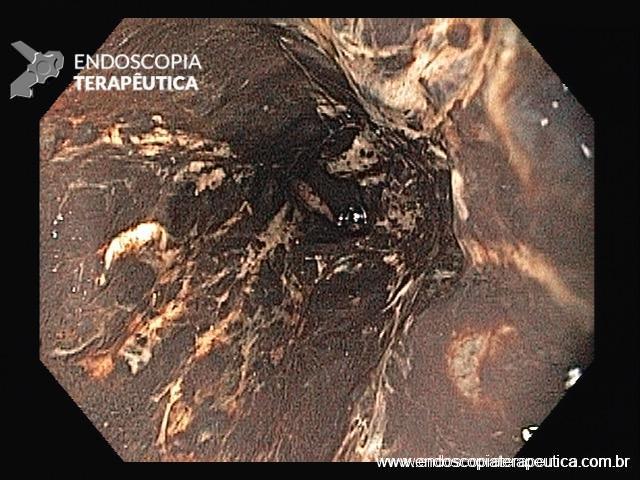
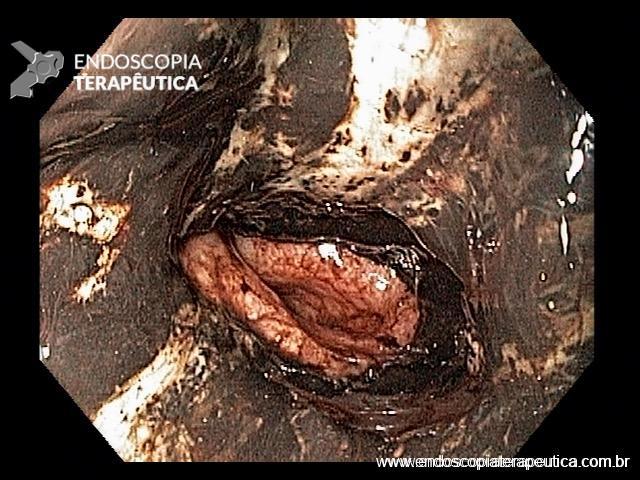
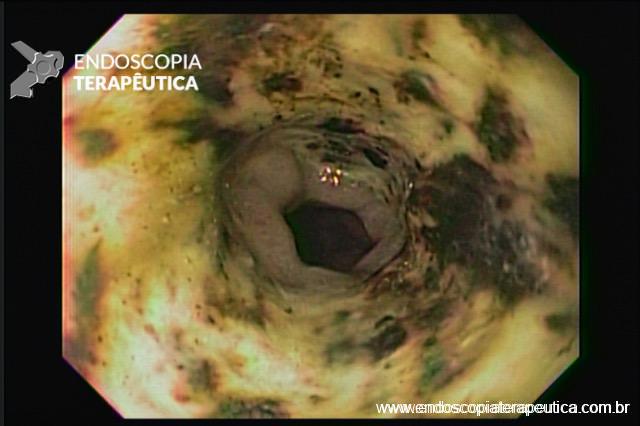
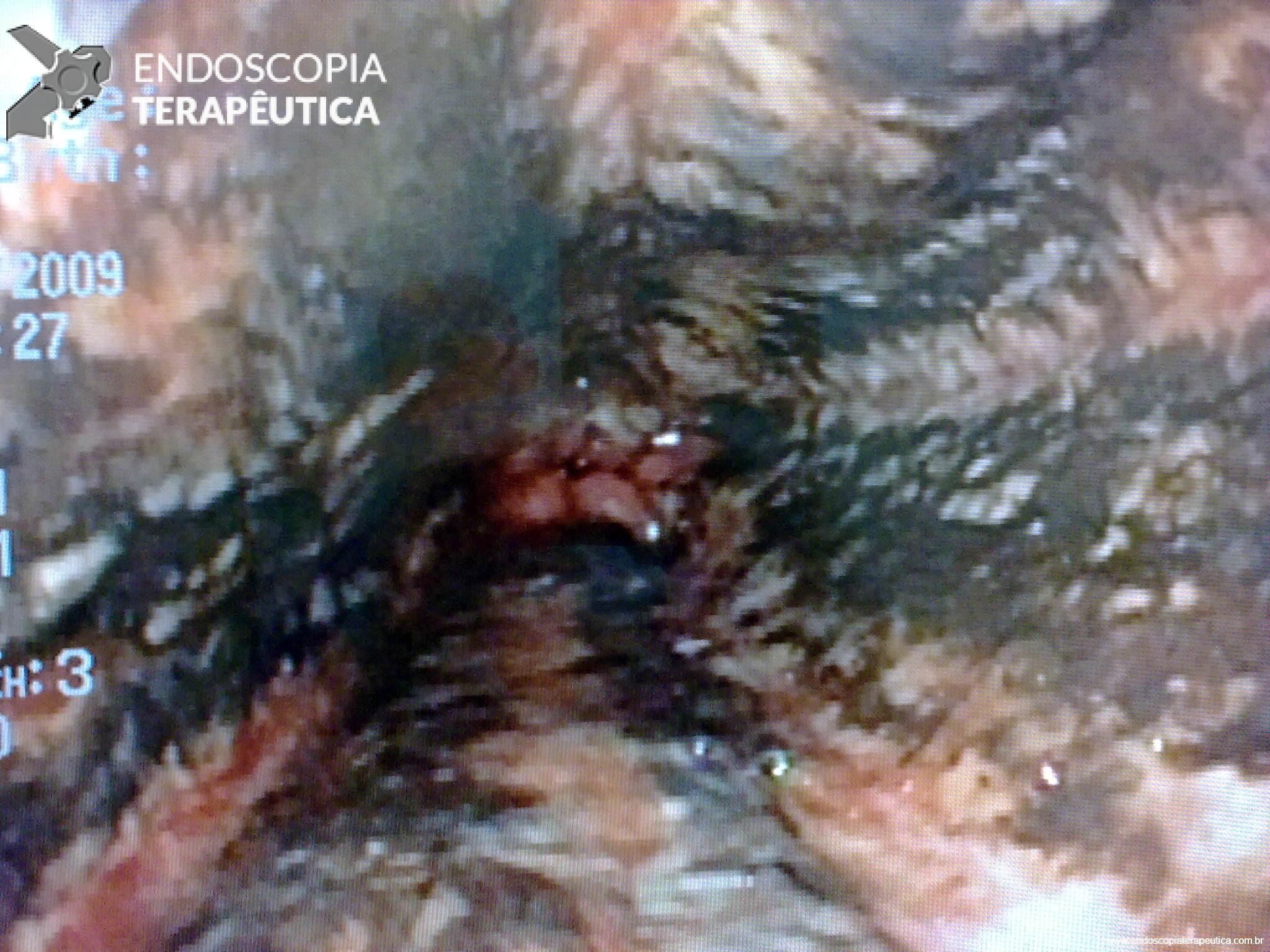
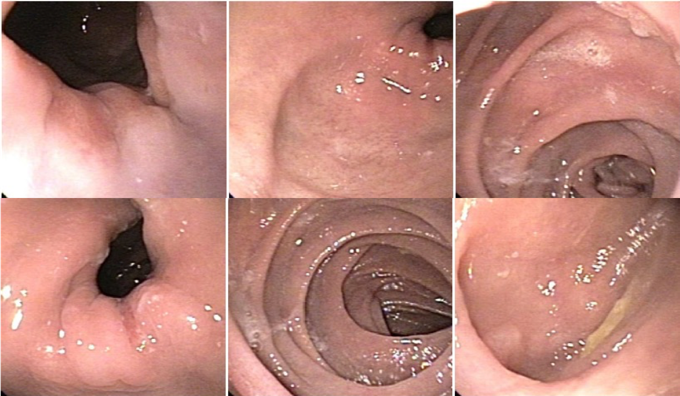
A necrose esofágica aguda (NEA), também conhecida como esôfago negro ou esofagite necrotizante, é uma síndrome rara caracterizada por uma aparência escurecida da mucosa, com comprometimento circunferencial difuso, que afeta principalmente os dois terços distais interrompendo-se abruptamente na junção gastroesofágica (a mucosa gástrica mantém-se normal).
EPIDEMIOLOGIA
A necrose esofágica aguda é uma condição rara com uma prevalência estimada de até 0,2 % em séries de autópsia. Em algumas séries de endoscopia, a prevalência da NEA variou de 0,001 a 0,2% dos casos. A incidência parece ser mais do que quatro vezes maior nos homens em comparação com as mulheres e os pacientes têm uma idade média de 68 anos no diagnóstico.
ETIOLOGIA E PATOGÊNESE
A etiologia da necrose esofágica aguda não é clara, mas a isquemia e a obstrução da saída gástrica podem ser eventos desencadeantes. Em alguns relatos tem sido associada ao uso de antibióticos de amplo espectro, infecções (por exemplo, candida albicans, citomegalovírus, vírus do herpes e klebsiella pneumoniae), volvo gástrico, hérnia paraesofágica, hiperglicemia, cetoacidose diabética, síndrome de Stevens-Johnson, vômitos intensos e prolongados, hepatite alcoólica, acidose lática e até dissecção aórtica. Ou seja, em geral são pacientes com quadro clínico bastante debilitado e com risco de comprometimento circulatório.
Outra hipótese para sua etiologia seria a presença de dois eventos associados, onde o inicial, um estado vascular de baixo fluxo, predisporia a mucosa à uma lesão intensa e o segundo causaria uma obstrução da saída gástrica levando à um acúmulo de líquido no estômago, o que promoveria um refluxo gastresofágico, resultando em lesão direta, e por fim, necrose. O que fortalece tal hipótese é que a redução temporária do fluxo sanguíneo esofágico pode resultar em necrose esofágica extensa que se resolve rapidamente quando o fluxo é reestabelecido. Além disso, a necrose esofágica aguda tende a ocorrer no terço distal do esôfago, que é relativamente hipovascularizado em comparação com outros segmentos esofágicos. A necrose da mucosa esofágica e submucosa, com trombose microscópica e recuperação rápida após o reestabelecimento do fluxo são eventos semelhantes aos ocorridos na colite isquêmica.
MANIFESTAÇÕES CLÍNICAS
Aproximadamente 70% dos pacientes com necrose esofágica aguda apresentam hemorragia digestiva alta com hematêmese e melena. Os sintomas podem aparecer rapidamente após um evento desencadeante. Outros sintomas gastrointestinais incluem: disfagia, dor epigástrica e dor torácica. Os pacientes também podem ter sintomas relacionados à patologia subjacente a qual predispôs ao evento desencadeante inicial e apresentarem-se com sinais de sepse, incluindo taquicardia e hipotensão.
ACHADOS LABORATORIAIS
Os achados laboratoriais não são específicos e frequentemente são devidos à doença subjacente. Eles incluem: acidose lática, hipoalbuminemia, anemia, insuficiência renal e hiperglicemia.
DIAGNÓTICO
A necrose esofágica aguda é habitualmente diagnosticada incidentalmente em pacientes submetidos à endoscopia digestiva alta para avaliação de sangramento gastrointestinal. Embora a aparência endoscópica seja sugestiva, são necessárias biópsias esofágicas para excluir outras etiologias e estabelecer o diagnóstico.
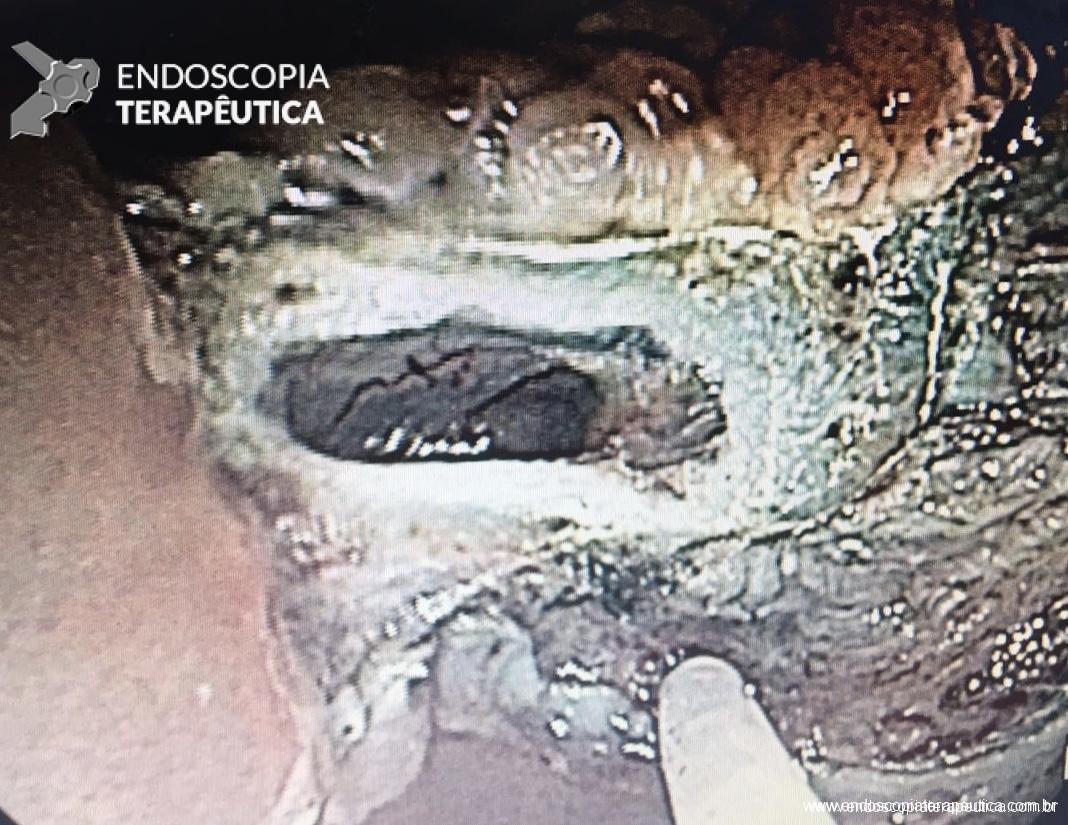
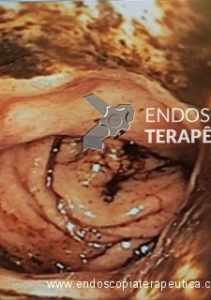
Endoscopia e biópsia – Na endoscopia, é caracterizada por descoloração periférica circunferencial com tecido hemorrágico friável subjacente associado a diminutos pontos enegrecidos, e também por uma delimitação precisa entre a mucosa esofágica e a gástrica, a qual tem aparência normal distalmente à junção gastroesofágica.
Geralmente envolve o terço distal do esôfago, embora o envolvimento proximal tenha sido descrito. À medida que a doença progride, o esôfago pode ficar parcialmente coberto com exsudatos brancos espessos que são descolados facilmente revelando um tecido de granulação rosa. Esses exsudatos provavelmente representam células mucosas espalhadas.
As biópsias servem para diferenciar a necrose de outras condições nas quais a mucosa também pode estar escurecida e também para descartar causas infecciosas, como por exemplo, candida albicans, citomegalovírus, vírus herpes simples e klebsiella pneumoniae.
Na histologia, há necrose extensa comprometendo a mucosa e a submucosa. Inflamação e destruição parcial de fibras musculares adjacentes podem ocasionalmente ser observadas, e os vasos sanguíneos às vezes são trombosados e/ou ocluídos.
DIAGNÓSTICO DIFERENCIAL
O diagnóstico diferencial inclui outras condições em que a mucosa esofágica também pode estar escurecida. A necrose esofágica aguda pode ser diferenciada destas condições pela história clínica e pela biópsia.
- Melanose – melanose esofágica tem sido descrita em pacientes com esofagite crônica subjacente. É mais comumente observada no esôfago distal. Em contraste com a necrose esofágica aguda, a descoloração é frequentemente focal. As biópsias revelam melanócitos com características de coloração de pigmento semelhantes à melanina.
- Pseudomelanose – A pseudomelanose é devida à deposição de tecido de pseudomelanina, um pigmento derivado da degradação lisossômica. Na histologia, um pigmento marrom composto por lipofuscina e melanina pode ser visualizado dentro dos macrófagos.
- Melanoma – O melanoma primário do esôfago é raro. Geralmente se origina no esôfago médio e distal e tem uma aparência polipoide. O diagnóstico é feito pela presença de atividade melanocítica juncional na avaliação histológica da mucosa esofágica.
- Acantose nigricans – é caracterizada por placas de aspecto aveludado, verrucoso e hiperpigmentado. Embora possa ser benigno, também pode ser um fenômeno paraneoplásico comumente associado a neoplasias malignas intra-abdominais.
- Resíduo de carvão – O pó de carvão ou o carbono é o pigmento exógeno mais comum a ser depositado nos tecidos do corpo humano. O mecanismo pelo qual o pó de carvão é depositado no esôfago não está claro.
- Ingestão cáustica – O dano esofágico grave causado pela ingestão de agentes corrosivos pode provocar desprendimento da mucosa e uma pigmentação preta da parede esofágica. Tais pacientes podem apresentar um histórico de ingestão cáustica e podem ter queimaduras orofaríngeas associadas.
- Esofagite Pseudomembranosa – geralmente é relatada em associação com graves doenças sistêmicas. Uma membrana concêntrica, fina, amarela ou preta, recobre os terços distais e, menos comumente, o esôfago inteiro. Pode ser desalojada da parede, revelando uma mucosa subjacente friável. Na histologia, a pseudomembrana não tem membrana basal e é composta por exsudato fibrinoso e células inflamatórias misturadas.
TRATAMENTO
Existem dados limitados para orientar o manejo da necrose esofágica aguda, e o gerenciamento de tal condição é amplamente baseado na experiência clínica.
A terapêutica inicial consiste em expansão de volume com fluidos intravenosos e tratamento da doença de base. A supressão do acidez gástrica com inibidores de bomba de prótons deve ser adotada para reduzir a lesão péptica adicional. A ingestão oral deve ser evitada por pelo menos 24 horas. O uso da suspensão de sucralfato deve ser considerado pelo seu papel na prevenção de lesão esofágica péptica associada.
As sondas nasogástricas ou nasoenterais devem ser evitadas, a menos que sejam usadas afim de descomprimir uma obstrução da saída gástrica ou se houver vômito persistente. Uma decisão sobre o uso de antimicrobiano e/ou antifúngico deve ser feita individualmente, especialmente na configuração de pacientes que estão criticamente doentes ou parecem estar sépticos.
HISTÓRIA NATURAL
Com cuidados de suporte, a resolução dos achados endoscópicos ocorre na maioria dos pacientes. No entanto, as taxas de mortalidade em pacientes com necrose esofágica aguda variam de 13 a 35%. A mortalidade é em grande parte devido à doença de base, sendo que apenas 6% das mortes são diretamente atribuíveis à complicações da NEA.
COMPLICAÇÕES
- Perfuração esofágica – A perfuração esofágica é uma complicação aguda da necrose esofágica que ocorre em menos de 7% dos pacientes, mas requer intervenção urgente dada a alta mortalidade associada. A presença de dor retroesternal ou lombar severa persistente pode indicar seu aparecimento. Pacientes com perfuração esofágica podem ter crepitação à palpação da parede torácica devido à presença de enfisema subcutâneo.
- Estenose esofágica – As estenoses esofágicas são complicações à longo prazo da necrose esofágica aguda e ocorrem em 25 a 40 % dos pacientes. Os pacientes com estenoses geralmente apresentam disfagia gradualmente progressiva e habitualmente requerem dilatação endoscópica.
VEJA MAIS IMAGENS ABAIXO
(clique para ampliá-las)
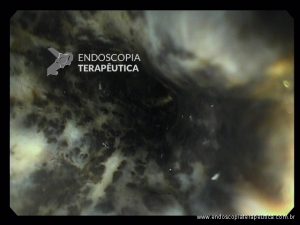
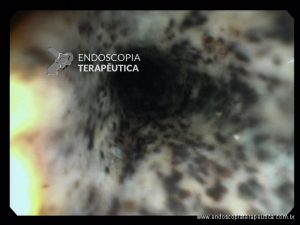

Confira também: Esofagite por cândida – Kodsi
Bibliografia
Quando devemos associar betabloqueador à nossa ligadura elástica?
Hemorragia digestiva alta (HDA) por varizes esofágicas (VE) é uma grave complicação da hipertensão portal, sobretudo em pacientes com cirrose hepática e outra descompensação da doença, como ascite, encefalopatia ou icterícia (1).
O risco de sangramento em pacientes com cirrose em seguimento por 1 ano é estimado em cerca de 12%, com mortalidade de até 30%. Por outro lado, a chance de ressangramento nos pacientes sem tratamento pode atingir 70%, com mortalidade semelhante à do primeiro episódio (1,2). Dessa forma, a prevenção adequada da HDA varicosa constitui um dos principais objetivos na abordagem da hipertensão portal desde o surgimento das primeiras estratégias de tratamento (2).
Os betabloqueadores não seletivos (BBNS) são muito eficazes nos diferentes estágios da cirrose hepática. Dados recentes sugerem que, em pacientes com cirrose compensada, podem reduzir a incidência de complicações clínicas (3). Em pacientes com VE de alto risco para sangramento (médio ou grosso calibre ou finas com sinais da cor vermelha e/ou Child B ou C), reduzem significativamente a incidência do primeiro sangramento. Naqueles com HDA varicosa prévia, previnem a recorrência do sangramento, em associação à ligadura elástica (LE), sendo que o mais importante componente dessa associação é a terapia farmacológica (3).
Com relação à profilaxia primária, as recomendações mais recentes mantem o uso de BBNS ou ligadura elástica (LE) como primeira opção. A escolha, nesse caso, baseia-se nos recursos disponíveis, na experiência do centro de tratamento e na preferência e características do paciente (4,5,6). Por outro lado, alguns estudos avaliaram o benefício da associação de BBNS à ligadura elástica na prevenção do primeiro sangramento em comparação à ligadura elástica isolada.
- O primeiro, publicado por Sarin e col. em 2005, incluiu 144 pacientes, sendo 72 para LE e 72 para LE associada ao propranolol. Não houve diferença na redução do sangramento ou da mortalidade entre os grupos, porém a recidiva das VE foi menor entre os pacientes que receberam a terapia combinada (7).
- Outro estudo, mais recente, incluiu 66 pacientes, 32 para LE e 34 para LE associada ao propranolol, com resultados semelhantes (8).
- Apesar desses e outros trabalhos mostrarem algum benefício, não está indicada, até o momento, a associação de BBNS à LE para os pacientes que nunca apresentaram HDA varicosa.
No que diz respeito à profilaxia secundária, não há dúvidas quanto à recomendação de associar-se BBNS à LE (4,5,6). A pergunta é: devemos fazê-lo em todos os pacientes?
- Reconhecidamente, alguns pacientes (cerca de 15% dos cirróticos) apresentam contraindicação ao uso da medicação.
- São consideradas contraindicações: Asma ou DPOC, doença vascular periférica, bloqueios cardíacos, insuficiência cardíaca descompensada, diabetes insulinodependente (com episódios de hipoglicemia) e alergia.
- Além disso, outros 15% dos pacientes com cirrose apresentam intolerância até mesmo a doses mínimas da medicação devido eventos adversos, tais como: broncoespasmo, fadiga, disfunção sexual e dispneia (3).
A grande discussão nos últimos anos, envolve o risco do uso de BBNS em pacientes com cirrose e doença hepática avançada. O racional seria o fato dos BBNS reduzirem o débito cardíaco. Pacientes com cirrose e ascite refratária são muito dependentes do débito cardíaco para manter uma pressão arterial média (PAM) adequada. Dessa forma, BBNS poderiam ocasionar piora da perfusão renal e síndrome hepatorrenal, uma condição de alta mortalidade (3).
Inicialmente, Sersté e col. observaram aumento da mortalidade associada ao uso de BBNS em pacientes com ascite refratária, o que levantou essa discussão (9). Um estudo subsequente não confirmou esses resultados, mas mostrou maior mortalidade associada ao uso de BBNS em pacientes com peritonite bacteriana espontânea (PBE) (10). Notadamente, em ambos, os pacientes em uso de BBNS apresentavam PAM significativamente mais baixa que os demais.
Contudo, diversos outros estudos desde então não repetiram esses resultados. Uma metanálise concluiu que o uso de BBNS não está associado ao aumento na mortalidade de pacientes com cirrose e ascite ou ascite refratária. Além disso, observou-se que, nos trabalhos que apresentaram efeitos deletérios significativos dos BBNS, havia diferença relevante na PAM entre os que usavam ou não a medicação (3, 11).
Portanto, a tendência é evitar associação de BBNS à LE em pacientes com cirrose hepática e pressão arterial baixa (PAS < 90 mmHg), principalmente na presença de ascite volumosa, ascite refratária ou PBE prévia. Esses achados refletem-se nas últimas recomendações quanto às doses da medicação:
- pacientes sem ascite – dose máxima de propranolol 320 mg/dia e de nadolol 160 mg/dia;
- pacientes com ascite – dose máxima de propranolol 160 mg/dia e de nadolol 80 mg/dia (4,5,6).
Em resumo:
- não devemos associar BBNS à LE em pacientes com cirrose para profilaxia primária do sangramento varicoso.
- No caso da profilaxia secundária, a medicação é fundamental e aparece como o mais importante componente dessa associação, porém não deve ser usada em pacientes com contraindicação ou intolerância.
- Atenção deve ser dada à monitorização dos parâmetros hemodinâmicos do paciente, em especial, aqueles com ascite volumosa, ascite refratária ou PBE prévia. Nesses pacientes, o uso da medicação deve ser visto com cautela e em doses mais baixas.
- Pressão arterial baixa (PAS < 90 mmHg) está associada a complicações, como síndrome hepatorrenal e, nesse caso, a medicação deve ser descontinuada.
REFERÊNCIAS:
- Garcia-Tsao G, Bosch J. Management of varices and variceal hemorrhage in cirrhosis. N Engl J Med 2010;362:823-32.
- Baiges A et al. Pharmacologic prevention of variceal bleeding and rebleeding. Hepatol Int. 2017.
- Garcia-Tsao G. The Use of nonselective betablockers for treatment of portal hypertension. Gastroenterol Hepatol. 2017;13(10):617-619.
- de Franchis R; Baveno V Faculty. Expanding consensus in portal hypertension. Report of the Baveno VI Consensus Workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015;63:743-52.
- Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J. Portal hypertensive bleeding in cirrhosis: Risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases. 2017;65:310-35.
- Bittencourt PL et al. Variceal Bleeding: Update of Recomendations from the Brazilian Association of Hepatology. Arq Gastroenterol 2017;54(4):349-355.
- Sarin et al. Endoscopic variceal ligation plus propranolol versus endoscopic variceal ligation alone in primary prophylaxis of varicela bleeding. Am J Gastroenterol 2005;100:797-804.
- Bonilha DQ et al. Propranolol associated with endoscopic band ligation reduces recurrence of esophageal varices for primary prophylaxis of variceal bleeding: a randomized-controlled trial. Eur J Gastroenterol Hepatol 2015;27(1):84-90.
- Sersté et al. Deleterious effects of beta-blockers on survival in patients with cirrhosis and refractory ascites. Hepatology 2010;52(3):1017-22.
- Mandorfer M et al. Nonselective β blockers increase risk for hepatorenal syndrome and death in patients with cirrhosis and spontaneous bacterial peritonitis. Gastroenterology 2014; 146(7):1680-90.
- Chirapongsathorn, S. et al. Nonselective β-Blockers and Survival in Patients With Cirrhosis and Ascites: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2016;14(8):1096-1104.
QUIZ! Disfagia
Mulher, 45 anos, com queixas de disfagia alta (cervical) progressiva, predominantemente para sólidos, há cerca de um ano e meio. Nega DM, HAS ou perda de peso neste intervalo de tempo. Não é tabagista ou etilista, tampouco possui histórico de neoplasias nos antecedentes clínicos. Como única intervenção cirúrgica, submeteu-se à gastroplastia redutora à Capella há 7 anos para tratamento de obesidade, sem relato de reganho de peso.
Exames laboratoriais revelaram Hb 9,1g/dL (12-16g/dL), Ht 28,5%, Ferro sérico 20µg/dL (37-145 µg/dL), Transferrina 80 µg/dL (250-380 µg/dL), Sat. Ferro 19% (20-40%).
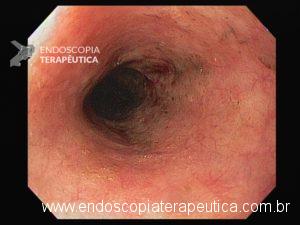
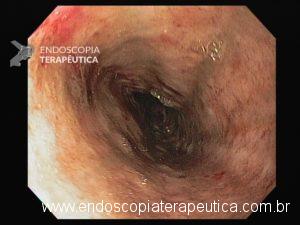
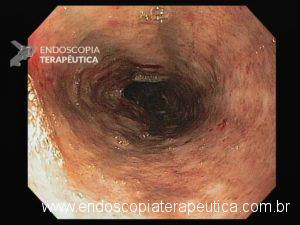
Realizou EDA:
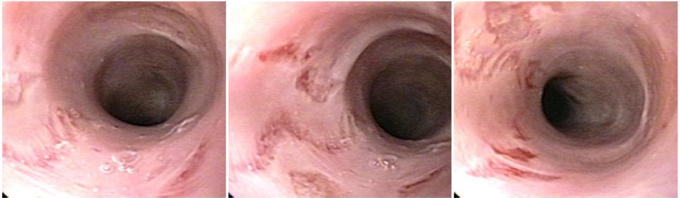
Área de estenose em esôfago proximal (15cm da ADS) com 1,5cm de extensão, que conferia moderada resistência à passagem do gastroscópio (9,8mm)
Estenose biliar pós transplante hepático
As complicações biliares pós-transplante hepático podem ocorrer em 6-40% dos pacientes, sendo mais frequentes após o transplante intervivos.
Elas podem ser precoces, ocorrendo nas primeiras 4 a 6 semanas (fístulas, biloma, estenoses e deiscência por necrose da anastomose biliar); ou tardias (fístulas, estenoses, colangite, coledocolitíase, cálculos, cast syndrome, disfunção do esfíncter de Oddi, mucocele, doença biliar recidivante).
As estenoses biliares pós-transplante hepático podem ainda ser classificadas em anastomóticas (Figura 1) e não anastomóticas (Figura 2). Suas características estão descritas na Tabela 1.
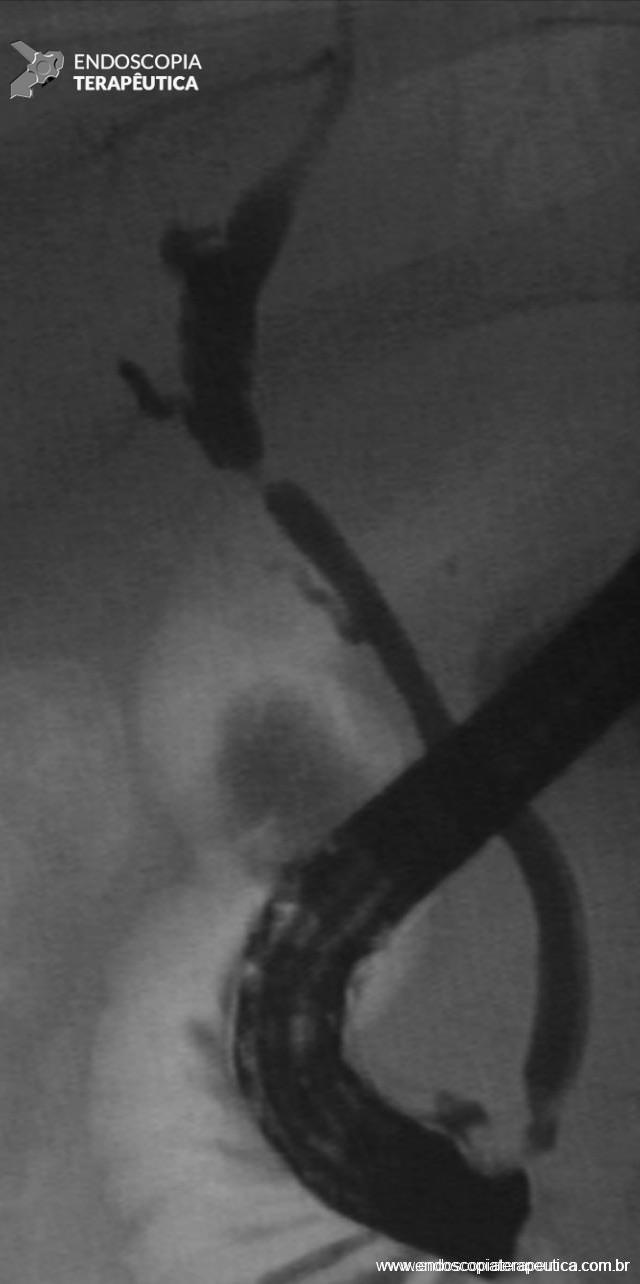
Figura 1 – Aspecto colangiográfico de estenose anastomótica após transplante hepático de doador cadáver.
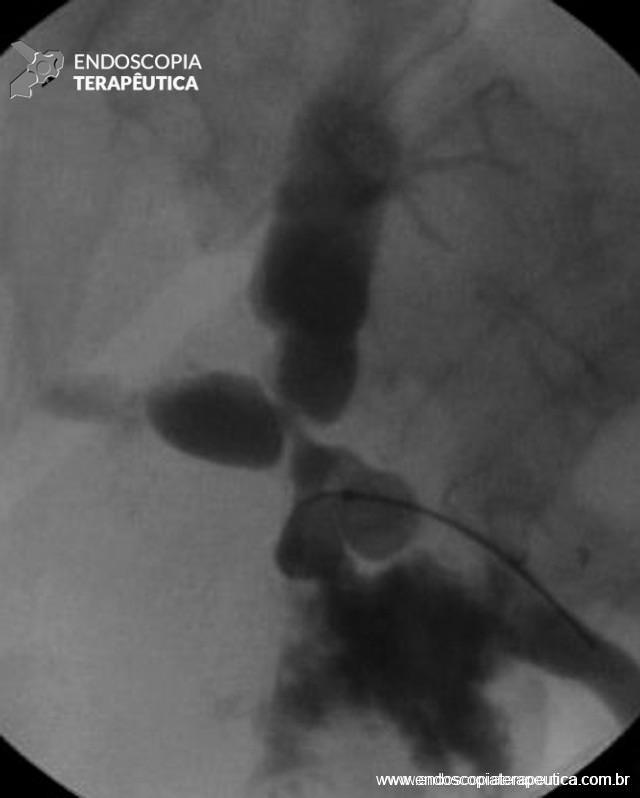
Figura 2 – Aspecto fluoroscópico de estenose não anastomótica (doador cadáver), acometendo o hilo hepático, associada à fístula biliar
Tabela 1: Características das estenoses biliares anastomóticas e não anastomóticas pós transplante hepático.
| Estenoses anastomóticas | Estenoses não anastomóticas | |
| Incidência
|
Doador cadáver: 5 – 15%
Intervivos (Figura 3): 19 – 40% |
5 -15% |
| Característica | Isoladas
Curtas em extensão |
Múltiplas, longas
Ductos intra-hepáticos Ducto do doador |
| Apresentação | 1o ano após transplante
(5 a 8 meses) |
Etiologia isquêmica: 3-6 meses
Etiologia imunológica: > 1 ano |
| Fatores de risco | Questões técnicas
Fístula biliar |
Lesões isquêmicas: trombose da artéria hepática, parada cardíaca, isquemia (quente ou fria), condições de preservação ou lesão de reperfusão
Lesões imunológicas: rejeição ductopênica, incompatibilidade ABO, polimorfismo de genes, doenças imunomediadas pré-existentes no receptor
Outros: infecção CMV e recidiva viral (HBV ou HCV) |
| Quadro clínico | Assintomáticos (alterações laboratoriais)
Sintomas inespecíficos: prurido, anorexia, icterícia e febre
Dor ausente (imunossupressão e denervação hepática) |
Assintomáticos (alterações laboratoriais)
Sintomas inespecíficos: prurido, anorexia, icterícia e febre
Dor ausente
Maior acúmulo de barro biliar: episódios recorrentes de colangite e formação de casts* |
| Diagnóstico | Exames laboratoriais: AST, ALT, bilirrubinas, FAL e δGT | Exames laboratoriais: AST, ALT, bilirrubinas, FAL e δGT |
| USG abdominal com Doppler: exame inicial (sensibilidade 38 a 66%) | USG abdominal com Doppler: exame inicial (sensibilidade 38 a 66%) | |
| CPRM: acurácia de 95% | CPRM: acurácia de 95%
Aspecto radiológico remete à colangite esclerosante primária devido à presença de estenoses múltiplas e extensas |
|
| Biópsia hepática | Excluir rejeição se alterações dos exames de bioquímica, sem dilatação comprovada da via biliar | |
* casts: descamação epitelial em molde, CPRM: colangiopancreato ressonância magnética
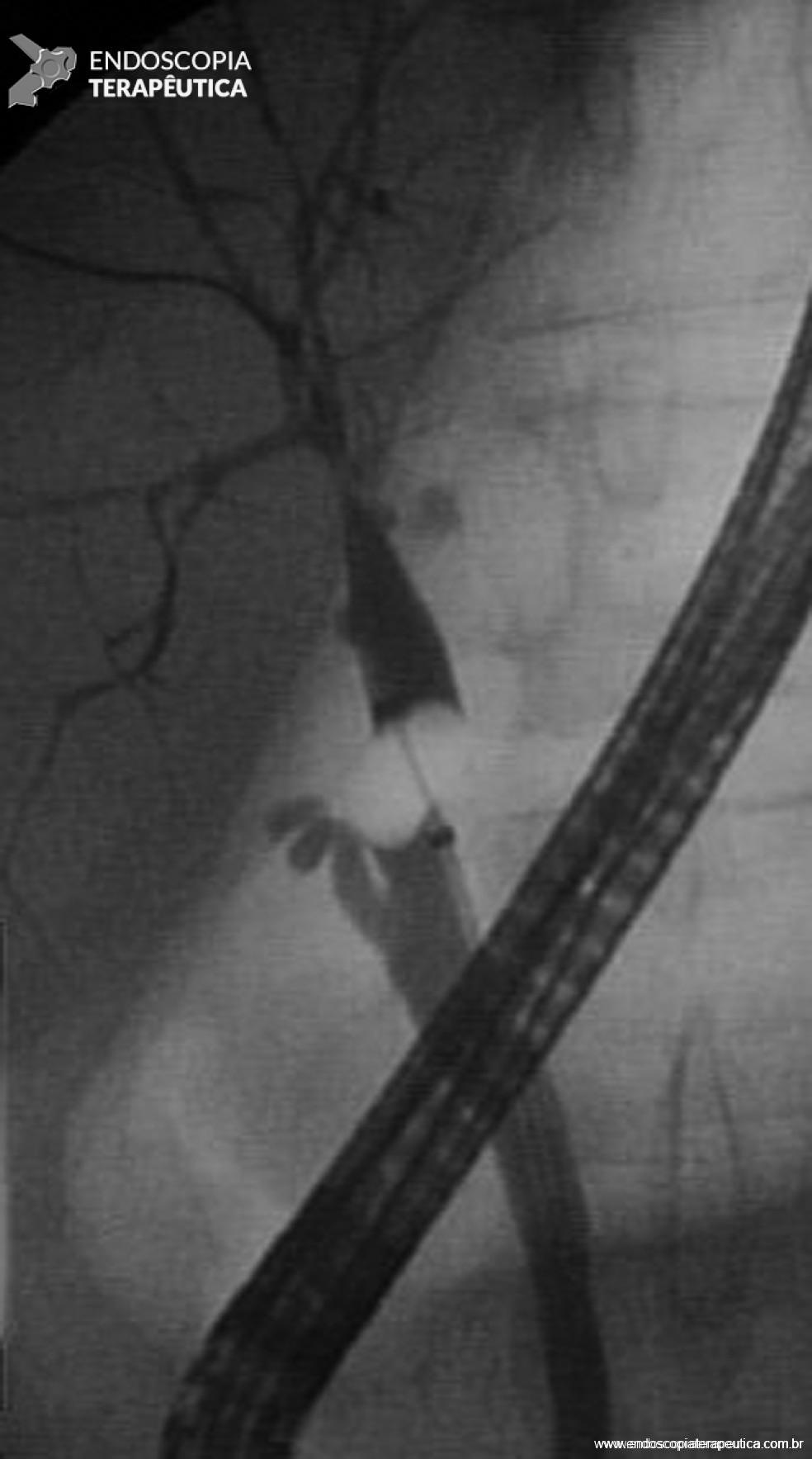
Figura 3 – Paciente transplantado hepático (doador vivo), com estenose complexa, anastomótica e não anastomótica, com lesões acometendo difusamente a via biliar intra-hepática.
A estenose biliar também é descrita no doador vivo, com incidência de 0,4% e 6%. É mais frequente quando o lobo hepático direito é utilizado. Os fatores de risco incluem a fístula biliar, idade avançada e o calibre do ducto biliar (< 4 mm). O quadro clínico é inespecífico, podendo haver colestase.
TRATAMENTO
Na última década, medidas não operatórias se tornaram a opção terapêutica de primeira linha para as complicações biliares pós transplante hepático. Nos pacientes com anastomose ducto-ducto a colangiografia retrógrada endoscópica (CRE) é a escolha inicial.
O tratamento endoscópico pode ser realizado por meio da dilatação com balão hidrostático ou dilatadores de passagem, seguida da colocação de uma ou mais próteses plásticas, ou ainda, mais recentemente, da prótese metálica autoexpansível totalmente coberta (PMAEC). Na presença de lesões da artéria hepática (insuficiência ou obstrução), estas devem ser abordadas durante o curso do tratamento.
A terapêutica com próteses plásticas múltiplas consiste na dilatação hidrostática da estenose seguida da colocação do maior número de próteses plásticas possível. Os pacientes devem ser submetidos à sessões repetidas, no prazo médio de três meses, para prevenção da oclusão, colangite e formação de cálculos. Todas as próteses devem ser retiradas, a estenose deve ser dilatada e um número progressivamente maior de próteses (Figura 4A e B) deve ser utilizado a cada troca, com objetivo de alcançar o maior diâmetro possível. O tratamento é completado em um ano e a maioria dos pacientes deve precisar de quatro a cinco procedimentos nesse período.
A terapia com prótese metálica totalmente coberta consiste na colocação de uma única PMAEC (Figura 5) após esfincterotomia biliar, sem necessidade de dilatação na maioria das vezes. O tempo de permanência ideal da prótese metálica ainda não está completamente definido. Os resultados do tratamento são favoráveis quando ela é mantida por período superior à 3 meses, não havendo comprovação à respeito do benefício da sua permanência por mais de 6 meses.
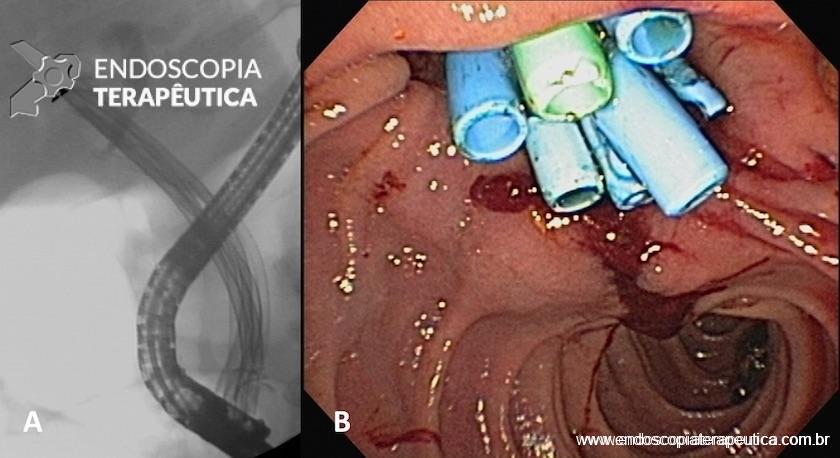
Figura 4 – Aspecto radiológico (A) e endoscópico (B) da estenose anastomótica (doador cadáver) tratada com dilatação hidrostática e colocação de próteses plásticas múltiplas.
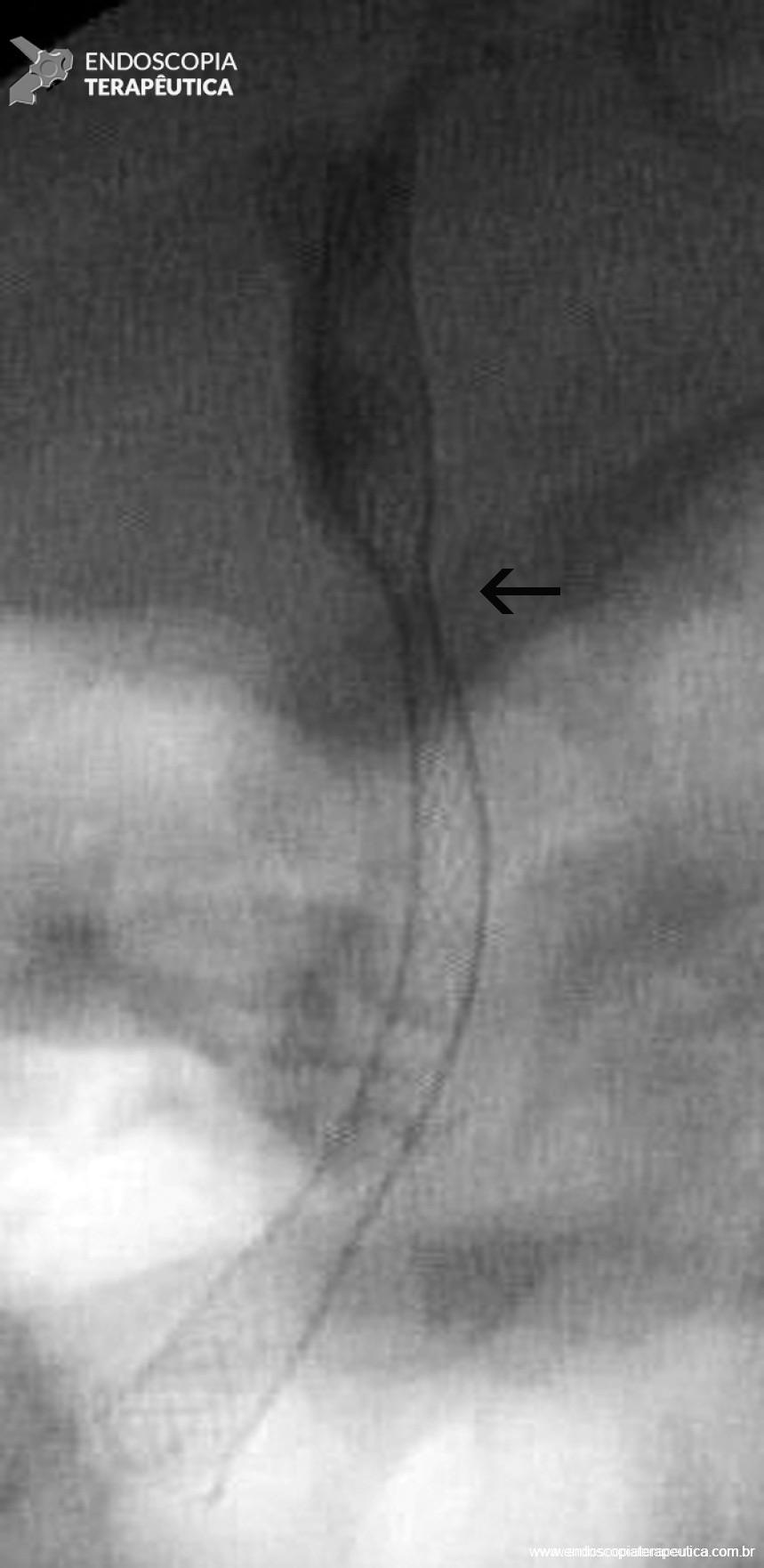
Figura 5 – Aspecto colangiográfico da PMAE totalmente coberta liberada evidenciando discreta compressão (seta), que corresponde ao ponto da estenose anastomótica.
Tabela 2: Comparação do tratamento com próteses plásticas múltiplas e prótese metálica auto-expansível totalmente coberta no tratamento das estenoses biliares pós transplante hepático.
| Próteses plásticas múltiplas | PMAEC | |
| Tempo de tratamento | 12 meses | ± 6 meses |
| Número de procedimentos | 4 a 5 | 2 |
| Taxa de sucesso
Estenose anastomótica
|
Doador cadáver: 82 a 98%
Doador vivo: 60 a 75%
|
87,5 a 100% |
| Taxa de sucesso
Estenose não anastomótica
|
Doador cadáver: 50 a 75%
Doador vivo: 25 a 33%
|
Não está indicada. |
| Taxa de complicações | 4 a 16% | 14,5 a 18% |
| Migração | 5 a 33,3% | 4 a 46,7% |
| Recidiva | 0 a 34% | 4,5 47,4% |
| Custo (6) | US$ 16.095 | US$ 6.903 |
PMAEC: prótese metálica auto-expansível totalmente coberta
Nos pacientes com estenose grave da anastomose direta ducto-ducto e falha no acesso profundo retrógrado à via biliar é possível a realização do procedimento combinado, com punção biliar percutânea ou guiada por EUS, seguida da terapia endoscópica rendez-vous. A colangioscopia direta também é uma ferramenta disponível para a transposição da estenose em caso de insucesso, com custo inferior ao das duas opções citadas anteriormente (Figura 6).
O tratamento cirúrgico fica reservado para os casos de insucesso da intervenção endoscópica ou radiológica e consiste na conversão da reconstrução para derivação biliar ou em casos extremos, o re-transplante.
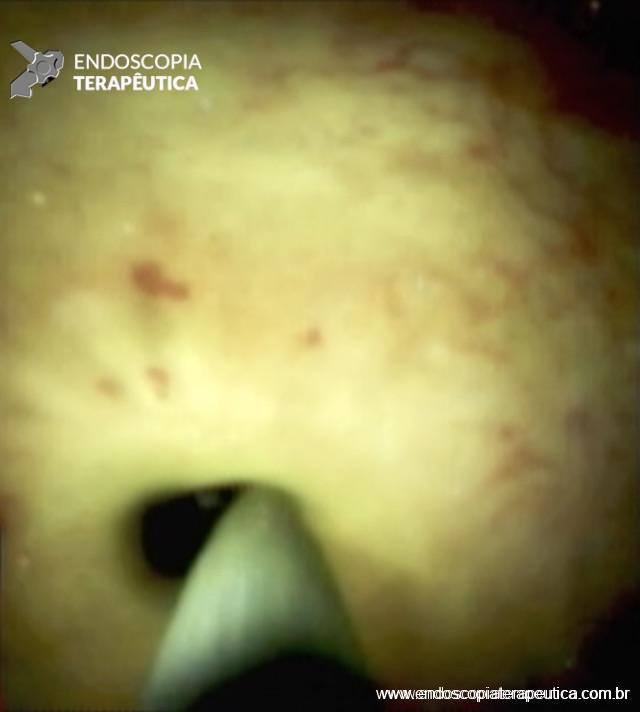
Figura 6 – Aspecto colangioscópico da passagem do fio guia pelo orifício da estenose da anastomose biliar.
Referências Bibliográficas
- Costamagna G, Tringali A, Mutignani M, Perri V, Spada C, Pandolfi M et al. Endotherapy of postoperative biliary strictures with multiple stents: results after more than 10 years of follow-up. Gastrointest Endosc. 2010;72:551-557.10.1016/j.gie.2010.04.052.20630514.
- Akamatsu N, Sugawara Y, Hashimoto D. Biliary reconstruction, its complications and management of biliary complications after adult liver transplantation: a systematic review of the incidence, risk factors and outcome. Transpl Int. 2011;24:379-392.10.1111/j.1432-2277.2010.01202.x.21143651.
- Chaput U, Vienne A, Audureau E, Bauret P, Bichard P, Coumaros D et al. Temporary placement of fully covered self-expandable metal stents for the treatment of benign biliary strictures. United European Gastroenterol J. 2016;4:403-412.10.1177/2050640615606550.27403307.
- Coté GA, Slivka A, Tarnasky P, Mullady DK, Elmunzer BJ, Elta G et al. Effect of Covered Metallic Stents Compared With Plastic Stents on Benign Biliary Stricture Resolution: A Randomized Clinical Trial. JAMA. 2016;315:1250-1257.10.1001/jama.2016.2619.27002446.
- Martins FP, Ferrari AP. Cholangioscopy-assisted guidewire placement in post-liver transplant anastomotic biliary stricture. Endoscopy 2018;49:E283-E284. 10.1055/s-0043-117940
- Martins FP, De Paulo GA, Contini MLC, Ferrari AP. Metal versus plastic stents for anastomotic biliary strictures after liver transplantation: a randomized controlled trial. Gastrointest Endosc. 2018;87:131e1-131e13. 10.1016/j.gie.2017.04.013.
…………………………………………………………………………………………………………..
Como citar esse artigo:
Martins FP. Estenose biliar pós transplante hepático. Endoscopia Terapêutica; 2018. Disponível em: https://endoscopiaterapeutica.net/pt/assuntosgerais/estenose-biliar-transplante-hepatico/
Artigos Comentados – Abril 2018
Apresentamos uma seleção de três artigos publicados recentemente que consideramos relevantes. Seguem abaixo:
High-Definition Colonoscopy vs Endocuff vs EndoRings vs Full-Spectrum Endoscopy for Adenoma Detection at Colonoscopy
Gastrointest. Endosc. 2018 Mar 09;[EPub Ahead of Print], DK Rex, A Repici, SA Gross, C Hassan, PL Ponugoti, JR Garcia, HM Broadley, JC Thygesen, AW Sullivan, WW Tippins, SA Main, GJ Eckert, KC Vemulapalli
BACKGROUND
Devices used to improve polyp detection during colonoscopy have seldom been compared with each other.
METHODS
We performed a 3-center prospective randomized trial comparing high-definition (HD) forward-viewing colonoscopy alone to HD with Endocuff to HD with EndoRings to the Full Spectrum Endoscopy (FUSE) system. Patients were age ≥50 years and had routine indications and intact colons. The study colonoscopists were all proven high-level detectors. The primary endpoint was adenomas per colonoscopy (APC) RESULTS: Among 1,188 patients who completed the study, APC with Endocuff (APC Mean ± SD 1.82 ± 2.58), EndoRings (1.55 ± 2.42), and standard HD colonoscopy (1.53 ± 2.33) were all higher than FUSE (1.30 ± 1.96,) (p<0.001 for APC). Endocuff was higher than standard HD colonoscopy for APC (p=0.014) . Mean cecal insertion times with FUSE (468 ± 311 seconds) and EndoRings (403 ± 263 seconds) were both longer than with Endocuff (354 ± 216 seconds) (p=0.006 and 0.018, respectively).
CONCLUSIONS
For high-level detectors at colonoscopy, forward-viewing HD instruments dominate the FUSE system, indicating that for these examiners image resolution trumps angle of view. Further, Endocuff is a dominant strategy over EndoRings and no mucosal exposure device on a forward-viewing HD colonoscope.
Comentários:
- No artigo, os autores apresentam os dados de um trial multicêntrico, randomizado, comparando colonoscopia de alta definição (HD), alta definição + Endocuff (HD Endocuff), alta definição + EndoRings (HD EndoRings) e endoscopia de espectro ampliado (full-spectrum endoscopy – FUSE). Foram incluídos 1188 pacientes, idade ≥50 anos, submetidos a colonoscopia de rotina.
- Uso do Endocuff obteve a maior taxa de detecção de adenomas por colonoscopia (APC), com valores significativamente maiores que uso de EndoRings e também colonoscopia padrão de alta definição, se traduzindo potencialmente na melhor técnica de aumento de exposição mucosa dentre as apresentadas.
- O sistema FUSE parece levar a maior tempo de intubação cecal sem evidente benefício no APC quando comparado as outras técnicas.
Feasibility and Safety of Micro-Forceps Biopsy in the Diagnosis of Pancreatic Cysts
Gastrointest. Endosc. 2018 Mar 03;[EPub Ahead of Print], O Basar, O Yuksel, D Yang, J Samarasena, D Forcione, CJ DiMaio, MS Wagh, K Chang, B Casey, C Fernandez-Del Castillo, MB Pitman, WR Brugge
BACKGROUND AND AIM
The tissue acquisition and diagnostic yield of cyst fluid cytology is low-to-moderate and rarely provides a specific diagnosis. The aim of this study was to compare the tissue acquisition and diagnostic tissue yield of micro-forceps biopsy (MFB) with cyst fluid cytology.
PATIENTS AND METHODS
The data of 42 patients, whose cysts were aspirated by EUS-guided fine needle aspiration (EUS-FNA) and then biopsied with MFB device in this multicenter study, were collected. Cytological analysis of cyst fluid and histological analysis of biopsy samples were processed. Acquisition yield was defined as percentage of patients with tissue present in the aspirate or biopsy. Diagnostic tissue yield was evaluated at 3 levels: the ability of differentiation between mucinous/non-mucinous cysts; detection of high-risk for malignancy; and specific cyst type diagnosis.
RESULTS
The mean patient age was 69 years. Sixteen (38.1%) cysts were localized in head, 17 (40.5%) body, and 9 (21.4%) in tail. The mean cyst size was 28.2 mm (12-60 mm); 25 of 42 (60%) were septated. EUS-FNA tissue (fluid) acquisition yield was 88.1% (37/42). MFB tissue acquisition yield was 90.4% (38/42). The diagnostic cytology yield to differentiate between mucinous/non-mucinous cyst was 47.6% (20/42) and MFB histological yield o differentiate between mucinous/non-mucinous cyst was 61.9% (26/42) (p=0.188). The percentage of cysts at high-risk for malignancy by cytology was 54.7% (23/42) and MFB was 71.5% (30/42) (p=0.113). However, the ability of MFB to provide a specific cyst type diagnosis was 35.7% (15/42) and cytology was 4.8% (2/42) (p=0.001). Surgical histology was concordant with MFB in 6 of 7 (85%) patients and with cytology in 1 of 7 (15%) patients.
CONCLUSION
The cyst tissue acquisition yield for the MFB was 90%. Although cytology of cyst fluid and MFB were comparable in distinguishing mucinous and non-mucinous cysts and detecting cysts at high-risk for malignancy, the MFB was far superior to cytology for providing a specific cyst diagnosis.
Comentários:
- Nessa coorte retrospectiva, os autores descreveram a aquisição de tecido e o valor diagnóstico com uso de biópsias por micropinças em cistos pancreáticos
- De um total de 42 pacientes com cistos pancreáticos submetidos a ecoendoscopia com punção por agulha fina e biópsias por micropinça (MFB), a capacidade de aquisição global de tecido foi de 90.4% (38/42) com MFB e 88.1% (37/42) com citologia do fluído.
- A capacidade de diferenciar entre cistos mucinosos x não mucinosos foi de 47.6% (20/42) com citologia e 61.9% (26/42) com MFB
- Um diagnóstico específico para os cistos foi apresentado em 35.7% dos casos (15/42) com MFB e 4.8% casos (2/42) com citologia, levando a conclusão sobre potencial a superioridade diagnóstica do uso de micropinça.
Outcomes of Endoscopic Balloon Dilation vs Surgical Resection for Primary Ileocolic Strictures in Patients With Crohn’s Disease
Clin. Gastroenterol. Hepatol. 2018 Mar 02;[EPub Ahead of Print], N Lan, L Stocchi, JH Ashburn, TL Hull, SR Steele, CP Delaney, B Shen
BACKGROUND & AIMS
Few studies have compared endoscopic balloon dilation (EBD) with ileocolic resection (ICR) in the treatment of primary ileocolic strictures in patients with Crohn’s disease (CD).
METHODS
We performed a retrospective study to compare post-procedure morbidity and surgery-free survival among 258 patients with primary stricturing ileo (colic) CD (B2, L1, or L3) initially treated with primary EBD (n=117) or ICR (n=258) from 2000 through 2016. Patients with penetrating disease were excluded from the study. We performed multivariate analyses to evaluate factors associated with surgery-free survival.
RESULTS
Post-procedural complications occurred in 4.7% of patients treated with EBD and salvage surgery was required in 44.4% of patients. Factors associated with reduced surgery-free survival among patients who underwent EBD included increased stricture length (hazard ratio [HR], 2.0; 95% CI, 1.3-3.3), ileocolonic vs. ileal disease (HR, 10.9; 95% CI, 2.6-45.4), and decreased interval between EBD procedures (HR, 1.2; 95% CI, 1.1-1.4). There were no significant differences in sex, age, race, or CD duration between EBD and ICR groups. Patients treated with ICR were associated with more common post-operative adverse events (32.2%, P<.0001), but reduced need for secondary surgery (21.7%, P<.0001) and significantly longer surgery-free survival (11.1±0.6 years vs. 5.4±0.6 years, P<.001).
CONCLUSION
In this retrospective study, we found that although EBD is initially successful with minimal adverse events, there is a high frequency of salvage surgery. Initial ICR is associated with a higher morbidity but a longer surgery-free interval. The risks and benefits should be balanced in selecting treatments for individual patients.
Comentários:
- Os autores apresentaram um estudo retrospectivo comparando dilatação endoscópica com balão (EBD) versus ressecção ileocolônica (ICR) no tratamento de estenoses ileocolônicas primárias em 258 pacientes com doença de Crohn (CD).
- Comparada a EBD, os pacientes tratados com ICR apresentaram mais eventos adversos pós operatórios (32,2%).
- Pacientes submetido a ICR contudo, tiveram menor necessidade de uma segunda cirurgia (21,7%) e tempo livre de cirurgia significativamente maior (11,1 x 5,4 anos).