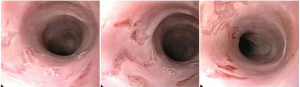
CÂNCER GÁSTRICO PRECOCE COM ULCERAÇÃO: SERÁ QUE É FÁCIL CARACTERIZAR?
A definição de Câncer gástrico precoce inclui lesões que acometem as camadas mucosa e submucosa independente do acometimento linfático. Alguns problemas surgem à partir daí:
- A definição de câncer gástrico precoce leva em conta a possibilidade de metástase linfática;
- O tratamento endoscópico está indicado para lesões com risco zero ou risco negligenciável de metástases linfáticas (Figura 1);
- Vários autores sugerem uma espécie de “redefinição” do conceito de câncer gástrico precoce levando em consideração as crescentes indicações de tratamento endoscópico;
- Sabe-se que a presença de ulceras é um dos fatores que impacta nas taxas de metástases linfáticas e, portanto, nas indicações de tratamento endoscópico para o câncer gástrico precoce;
- Será que é fácil diagnosticar e caracterizar ulcerações nas lesões gástricas precoces?
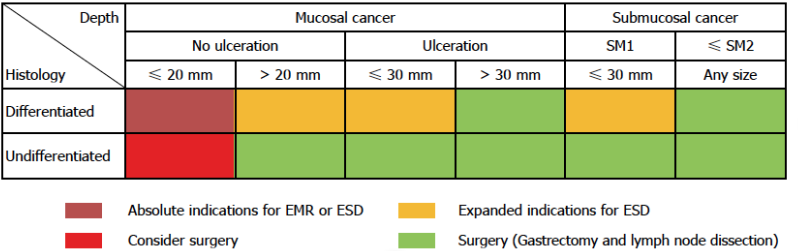
FIGURA 1. INDICAÇÕES CLÁSSICAS E EXPANDIDAS PARA O TRATAMENTO ENDOSCÓPICO DO CÂNCER GÁSTRICO PRECOCE
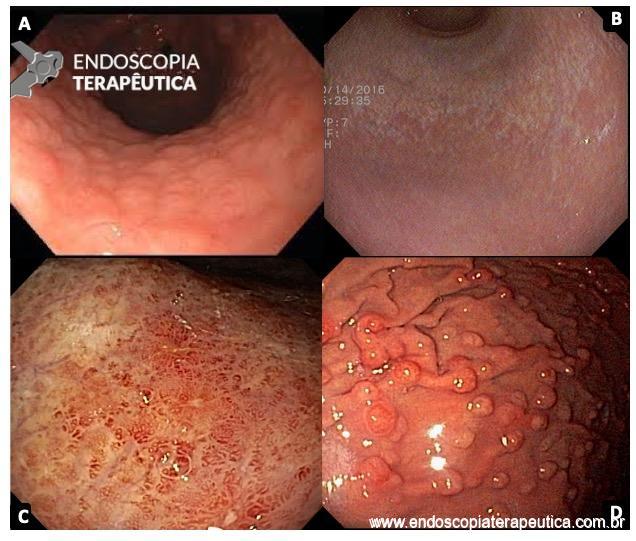
De acordo com as diretrizes japonesas existem quatro fatores que impactam nas indicações de tratamento endoscópico para o câncer gástrico precoce: tamanho, diferenciação, profundidade e presença de ulcerações (FIGURA 1). Três desses fatores (tamanho, profundidade e presença de ulceração) são usualmente determinados durante o exame endoscópico.
No estudo original de Gotoda, no ano 2000, as ulcerações foram definidas com base na avaliação patológica de espécimes cirúrgicos de acordo com a presença de convergência de pregas, fibrose na submucosa ou deformidade de camada muscular própria, e não em alterações descritas durante o exame endoscópico das lesões.
Nas rotinas de avaliação dos pacientes portadores de lesões gástricas precoces, a definição da presença ou não de ulceração é feita durante o exame de endoscopia que antecede o tratamento do paciente, seja ele endoscópico ou cirúrgico. Fica a dúvida se a caracterização inadequada dessas ulcerações poderia conduzir os pacientes a tratamentos mais agressivos e, por vezes, desnecessários.
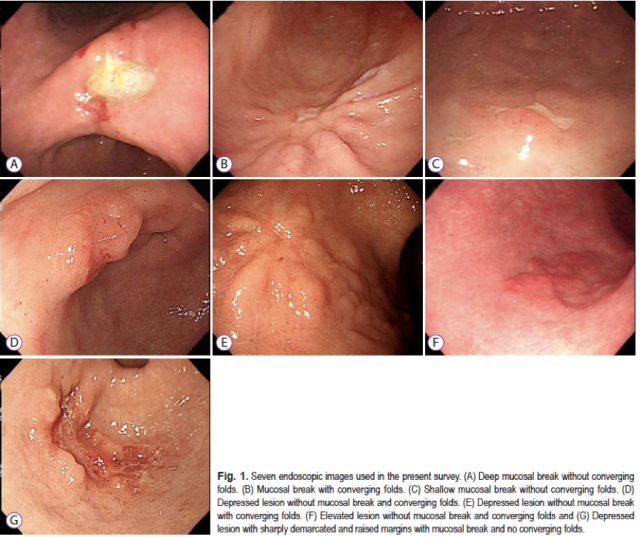
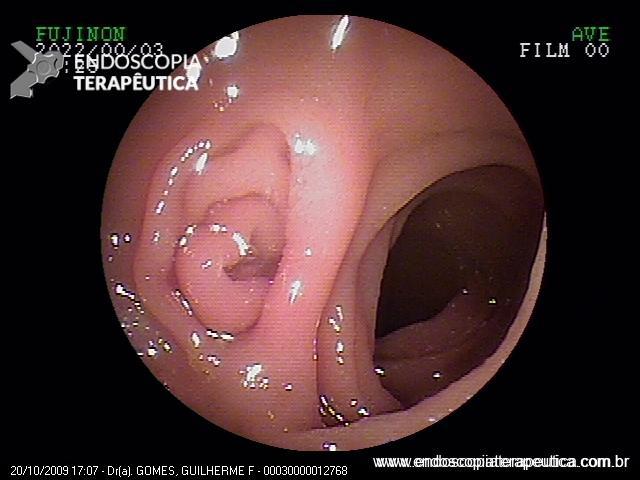
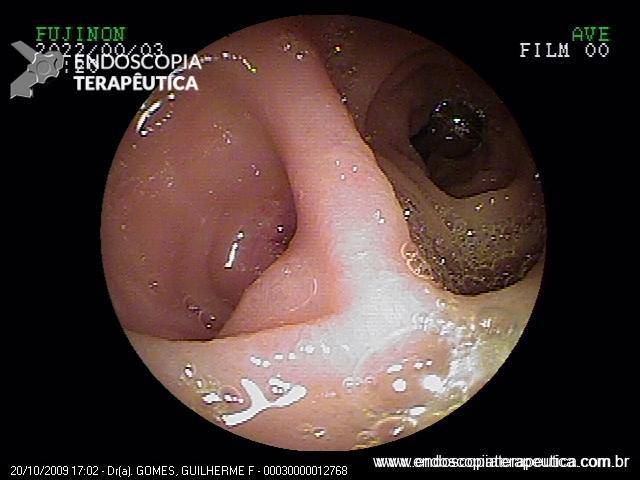
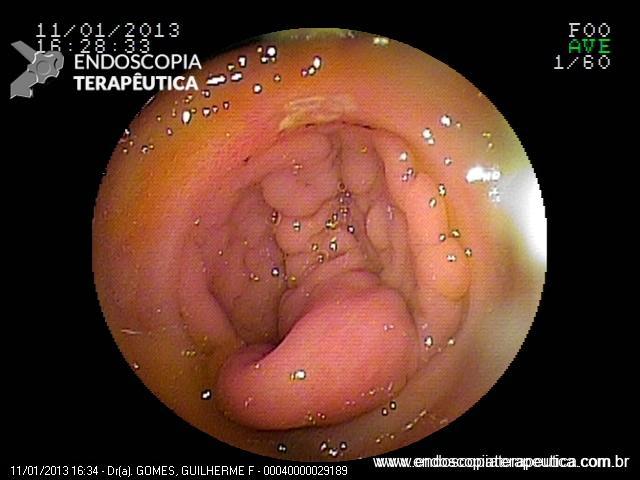
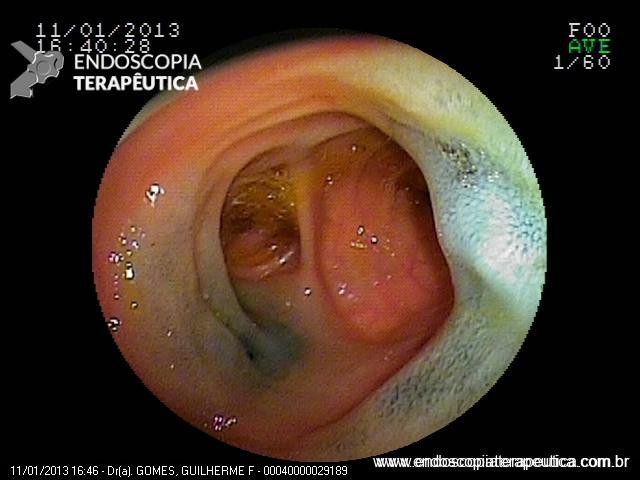
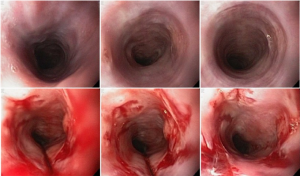
Sung Park e colaboradores conduziram um estudo muito interessante, publicado no periódico Clinical Endoscopy no ano de 2017, para avaliar se os endoscopistas eram capazes de diagnosticar a presença de ulceração durante a caracterização de uma lesão gástrica precoce. Endoscopistas receberam um questionário via e-mail com sete imagens endoscópicas de lesões bem diferenciadas tratadas cirurgicamente (FIGURA 2). Em quatro delas (imagens A, B, E e G) havia ulceração descrita durante a análise histopatológica (fibrose em camada submucosa ou muscular própria).
A conclusão dos autores foi que a definição da presença ou não de ulceração variou bastante entre os endoscopistas, principalmente para as lesões que não apresentavam ruptura da integridade mucosa e nem convergência de pregas (FIGURA 3). A presença de ulceração foi superestimada nos grupos com menor experiência endoscópica, o que levaria esse grupo a indicar tratamentos mais “agressivos” para um grupo de pacientes que poderia se beneficiar do tratamento endoscópico.
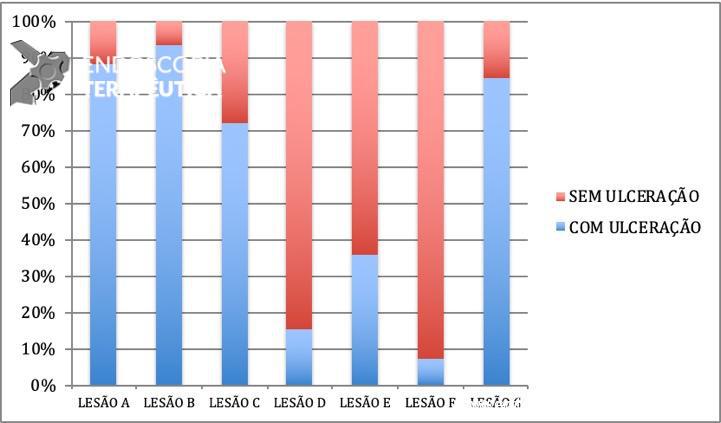
FIGURA 3. RESUMO DAS RESPOSTAS AOS QUESTIONÁRIOS (Adaptada do artigo original de Park, SM et al. Clinical Endoscopy 2017)
A maior parte dos endoscopistas ficou mais à vontade para diagnosticar ulcerações quando haviam depressões e rupturas da integridade da mucosa (nas figuras A,B,C e G). A presença de convergência de pregas não foi valorizada como um aspecto associado à presença de ulcerações. Cerca de 64% dos endoscopistas diagnosticaram a lesão E como sem ulceração, quando na verdade a presença de convergência de pregas traduz a presença de fibrose em submucosa ou em camadas mais profundas, ou seja, significa ulceração.
Os autores deixam a mensagem que o diagnóstico de ulceração no câncer gástrico precoce ainda envolve muitos questionamentos e dificuldades e que treinamento e experiência do endoscopista são fundamentais para melhorar as indicações de tratamento endoscópico.
Um ponto interessante levantado por esse estudo foi que toda a fundamentação das indicações de tratamento endoscópico foi feita há cerca de 20 anos com base em espécimes cirúrgicos e com base na definição histopatológica da presença de ulcerações, e não com base em aspectos endoscópicos. Os equipamentos endoscópicos evoluíram bastante nesse período e hoje a maior parte dos serviços dispõe de equipamentos com alta definição de imagem e recursos de cromoscopia. Estudos que reforçam as indicações de tratamento endoscópico com base em critérios endoscópicos que sejam de fácil reconhecimento para o endoscopista se fazem necessários.
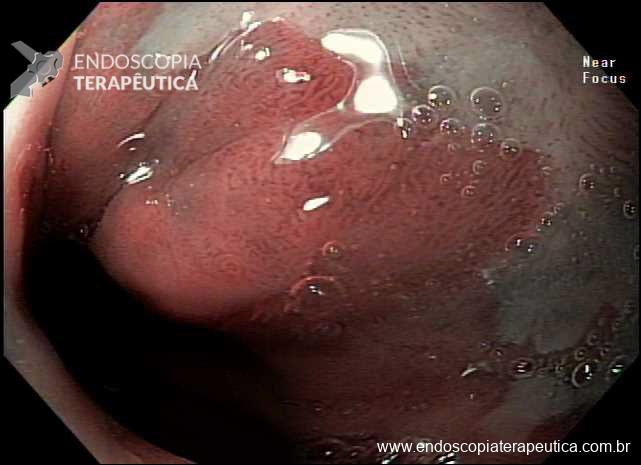
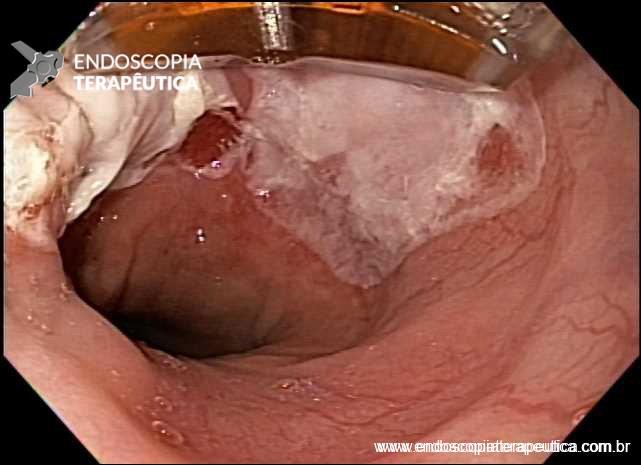
Além disso, uma informação prática e de grande importância para os endoscopistas, é que a presença de ruptura da integridade da mucosa e a convergência de pregas são aspectos importantes que definem a presença de ulcerações nas lesões gástricas precoces.
REFERÊNCIAS:
- Park SM, Kim BW, Kim JS et al. Can EndoscopicUlcerationsin Early Gastric Cancer Be Clearly Defined before EndoscopicResection? A Survey among Endoscopists. Clin Endosc. 2017 Sep;50(5):473-478.
- Barreto SG, Windsor JA. Redefining earlygastric cancer. Surg Endosc. 2016 Jan;30(1):24-37.
- Lee HL. Identificationof Ulcerationin Early Gastric Cancer before Resection is Not Easy: Need for a New Guideline for Endoscopic Submucosal Dissection Indication Based on Endoscopic Image. Clin Endosc. 2017 Sep;50(5):410-411.
- Gotoda T, Yanagisawa A, Sasako M et al. Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer. 2000Dec;3(4):219-225.