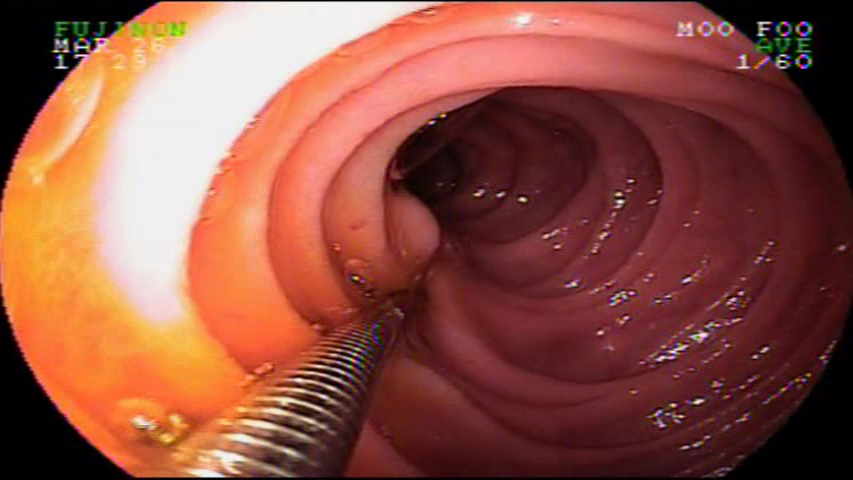
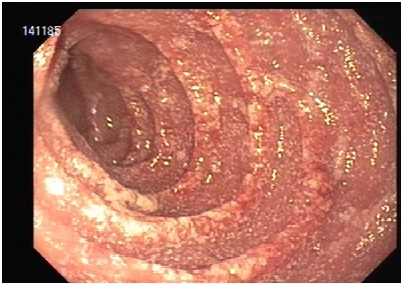
Os tumores neuroendócrinos gástricos são lesões compostas por hiperplasia das células enterocromafin-like. Os padrões histológicos são variados e confirmam-se pela imunohistoquímica, tendo positividade para marcadores como cromogranina A.
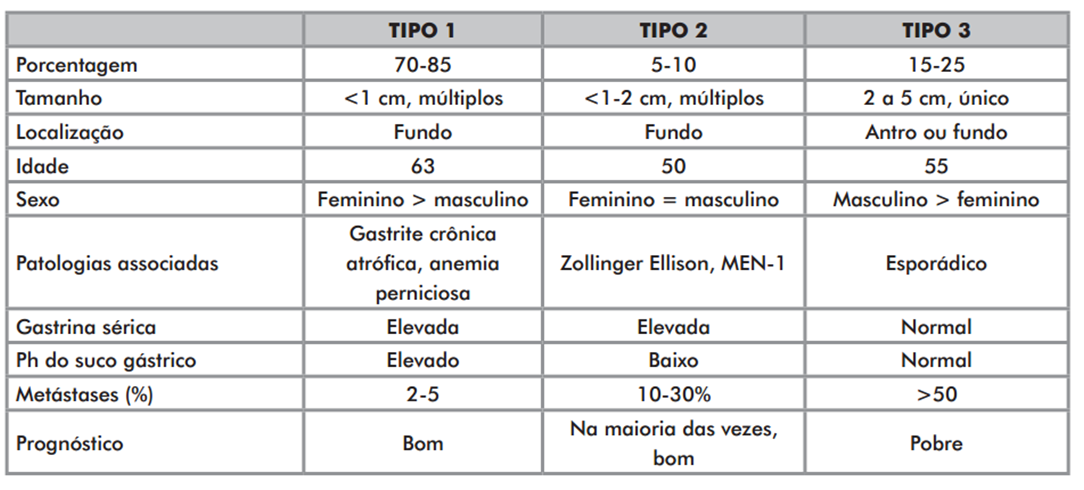
Os tumores neuroendócrinos (TNE) gástricos são divididos clinicamente em três tipos:
Tipo 1: mais comum (80%), ocorre num contexto de gastrite atrófica associado a hipergastrinemia, geralmente múltiplos. Apresentam-se como pequenos nódulos no corpo e limitados à submucosa e mucosa. Geralmente benignos, podendo regredir. As metástases linfonodais são raras, podendo ocorrer em lesões maiores de 2 cm.
Tipo 2: são raros (5%), geralmente menores que 1,5 cm, multifocais no corpo e associado a síndrome neuroendócrina múltipla (MEN tipo 1) e síndrome de Zollinger Ellison. Há metástase em 30% dos casos, preferencialmente quando lesões maiores de 2 cm e com invasão da muscular própria.
Tipo 3: segundo mais comum (15%), é esporádico, solitário e sem associação com gastrite atrófica e sem hipergastrinemia. Ocorrem em qualquer local do estômago e, como os demais, as metástases estão relacionadas com o tamanho, presença de invasão angiolinfática e invasão da muscular própria.
A nova classificação histológica dos TNE gástricos, da Organização Mundial de Saúde, é feita através da contagem mitótica em campos de grande aumento (10 HPF) e pelo índice de Ki67, sendo assim divididos em:
Grau I (bem diferenciado, cerca de 90%): Ki67 ≤ 2% e < 2 mitoses/10 campos de maior aumento;
Grau II (bem diferenciado): Ki67 de 3 a 20% e 2 a 20 mitoses/10 cma;
Grau III (pouco diferenciado): Ki67 > 20% e mitose > 20/10 cma.
Quanto a conduta, deve-se considerar a classificação clínica, o grau histológico, o grau de invasão, o número de lesões, o tamanho do tumor e a presença de invasão angiolinfática ou de metástases.
Nos tumores do tipo 1 e 2, nos casos em que há menos de 5 pólipos e o maior deles for inferior a 1 cm é recomendado ressecção endoscópica, se não houver invasão da camada muscular própria (quando diagnosticado por ecoendoscopia antes da ressecção). O acompanhamento é feito com endoscopia digestiva alta anualmente. Quando houver margens comprometidas da ressecção endoscópica, a ressecção cirúrgica local está indicada (gastrectomia subtotal).
Fatores de risco para doença metastática:
– Invasão da muscular própria
– Invasão angiolinfática
– Classificação histológica grau III (pouco diferenciado)
Tumores neuroendócrinos que apresentam qualquer fator de risco para metástase ou classificados clinicamente como tipo 3, está indicada a gastrectomia com linfadenectomia.
Nos casos de metástases, há opções como técnicas de radiologia intervencionista, radioterapia para disseminação óssea sintomática e quimioterapia em doença metastática irressecável.
CASOS CLÍNICOS
Caso 1: feminina, 32 anos, com hipotireoidismo e depressão, refere pirose e epigastralgia diariamente, sem sinais de alarme. Na EDA, evidenciaram-se pólipos em corpo gástrico e gastrite antral erosiva plana moderada, foram feitas polipectomias. À biópsia e imunohistoquímica, constatou-se tumor neuroendócrino (cromogranina positivo) , Grau I (Ki67 < 2%) , apresentando também atrofia, metaplasia intestinal e padrão morfológico sugerindo gastrite autoimune. Exame laboratorial demonstrou hipergastrinemia, anti- célula parietal positivo e deficiência de vitamina B12. A conduta feita foi reposição de vitamina B12 e orientações quanto ao quadro e seguimento endoscópico.
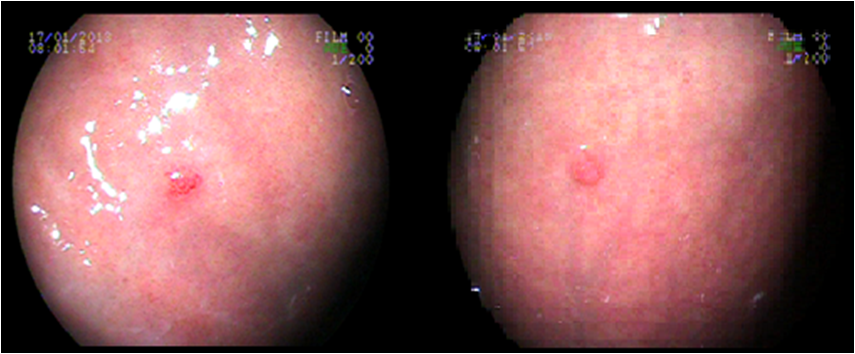
CLASSIFICAÇÃO CLÍNICA: Tipo 1 CLASSIFICAÇÃO HISTOLÓGICA: Grau I
Caso 2: masculino, 33 anos, com queixa de dispepsia intermitente há 10 meses, tem hipotireoidismo. É irmão da paciente do caso 1. EDA evidenciou pangastrite enantematosa leve e pólipos gástricos. À biópsia e imunohistoquímica, constatou-se tumor neuroendócrino (cromogranina positivo), Grau II (Ki67 7 %) , invadindo submucosa e com margem profunda comprometida. Apresentando também atrofia, metaplasia intestinal e padrão morfológico sugerindo gastrite autoimune. Devido as margens de ressecção comprometidas e grau histológico um pouco mais agressivo foi indicado o tratamento cirúrgico do qual o paciente se recusou em fazer e perdeu o acompanhamento.
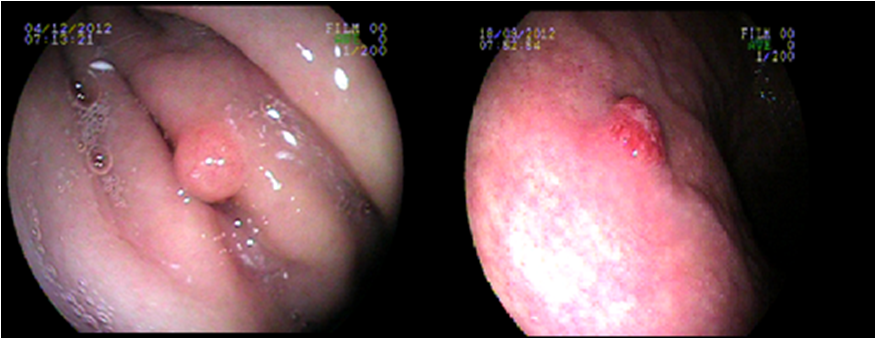
CLASSIFICAÇÃO CLÍNICA: Tipo 1 CLASSIFICAÇÃO HISTOLÓGICA: Grau II
Caso 3: feminina, 37 anos., com queixa de epigastralgia,. Endoscopia evidenciando pólipos em corpo gástrico sendo um com cerda de 10mm, sendo este ressecado por mucosectomia. Diagnóstico histológico e imunohistoquímico compatível com tumor neuroendócrino, invasor da submucosa e margens cirúrgicas comprometidas, associado a gastrite atrófica. Laboratório com hipergastrimenia e investigação de metástase a distância negativa. Paciente submetida a gastrectomia parcial devido margens cirúrgicas comprometidas.
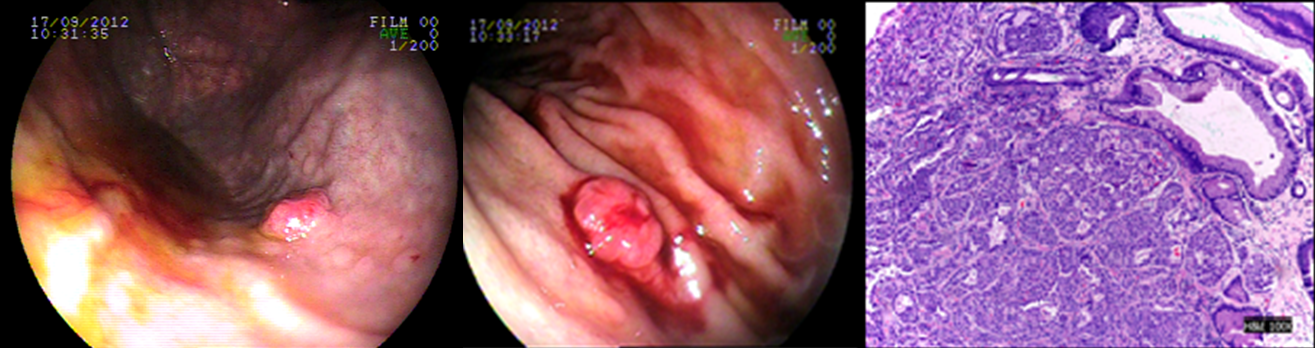
CLASSIFICAÇÃO CLÍNICA: Tipo 1 CLASSIFICAÇÃO HISTOLÓGICA: Grau I
Caso 4: feminina, 60 anos, HAS prévia, tendo como queixa principal pirose. EDA apresentando 2 pólipos gástricos na grande curvatura sendo o maior com cerca de 8mm. À biópsia e imunohistoquímica, constatou-se pólipo hiperplásico e o outro como tumor neuroendócrino (cromogranina positivo), Grau I (Ki67 <2%), sem invasão angiolinfática, com margem profunda comprometida, sem atrofia associada. Solicitado tomografia de abdome e gastrina sérica. Paciente não retornou e o seguimento do caso foi perdido.
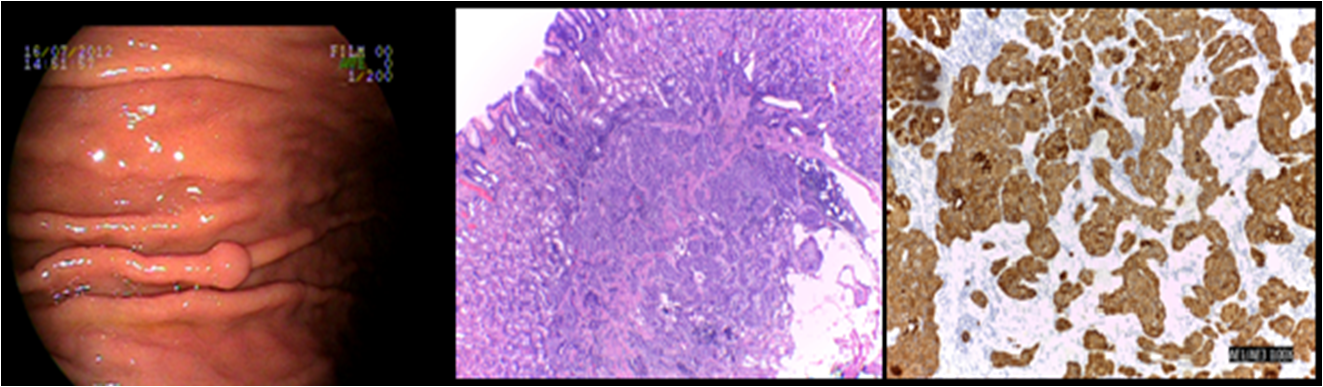
CLASSIFICAÇÃO CLÍNICA: Tipo 3 CLASSIFICAÇÃO HISTOLÓGICA: Grau I
Discussão
Os pacientes dos casos 1 e 2 possuem hipotireoidismo e atrofia gástrica, sendo por um com gastrite autoimune confirmada, mostrando a relação que pode existir entre as doenças autominues
Os pacientes dos casos 1 e 2 são irmãos sugerindo a associados do tumor neuroendócrino com fatores genéticos ou com doenças autoimunes que levam a atrofia da mucosa gástrica
Os pacientes dos caso 2 e 3 apresentaram margem cirúrgica comprometida após a ressecção endoscópica tendo sido indicada complementação cirúrgica das lesões.
O paciente do caso 4 apresentava lesão única não associada a gastrite atrófica o que poderia sugerir a classificação clinica como tipo 3. Fala contra este hipótese o pequeno tamanho da lesão.
Conclusão
Apesar de ser uma neoplasia rara, tem-se demonstrado um aumento progressivo da incidência dos tumores neuroendócrinos gástricos e representam atualmente cerca de 10% de todos os TNE gastrointestinais
Constituem um espectro de neoplasias com características clínico-patológicas, mecanismo patogênico e prognóstico diferentes do adenocarcinoma
O conhecimento deste complexo tema com suas classificações e apresentações é de fundamental importância para a condução adequada de tumores desta linhagem
Bibliografia
Dal Pizzol AC, Linhares E, Gonçalves R, Ramos C. Tumores Neuroendócrinos do Estômago: Série de Casos. Revista Brasileira de Cancerologia 2010; 56(4):453-461, Outubro 2010.
Pathology and Genetics of Tumours of the Digestive System. World Health Organization Classification of Tumours 2010. p. 53-57.
College of American Pathologists .Protocol for the Examination of Specimens From Patients With Neuroendocrine Tumors (Carcinoid Tumors) of the Stomach. Based on AJCC/UICC TNM, 7th Edition.
Ruszniewski P, Delle Fave G, Cadiot G, et al. Frascati Consensus Conference; European neuroendocrine Tumor Society. Well-differentiated gastric tumors/ carcinomas. Neuroendocrinology 2006;84:158–64.