Classificação EGGIM – Endoscopic Grading of Gastric Intestinal Metaplasia
Objetivo
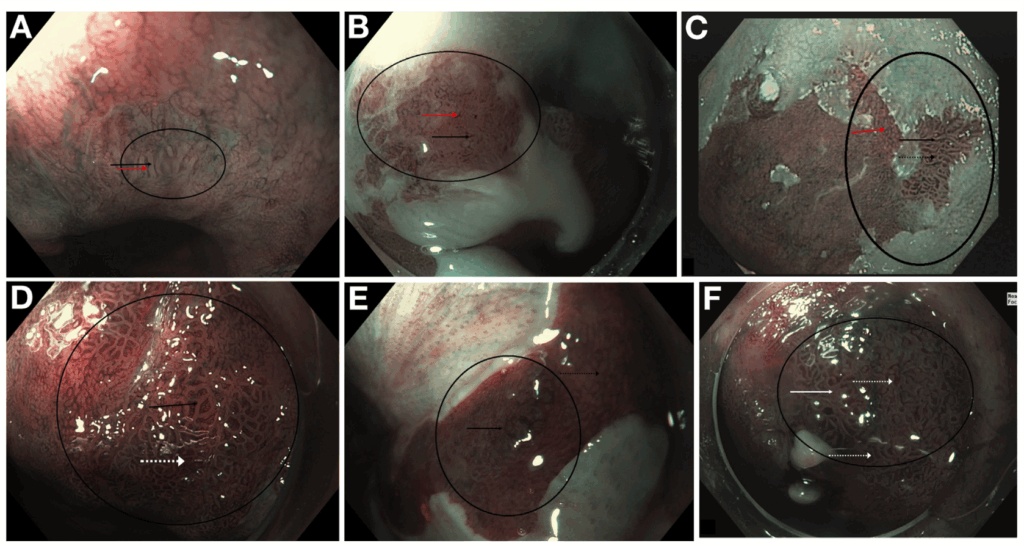
Fornecer uma avaliação endoscópica, baseada em NBI (narrow-band imaging), da extensão da metaplasia intestinal gástrica (GIM), permitindo estratificar risco para câncer gástrico sem a necessidade de múltiplas biópsias.
Critérios
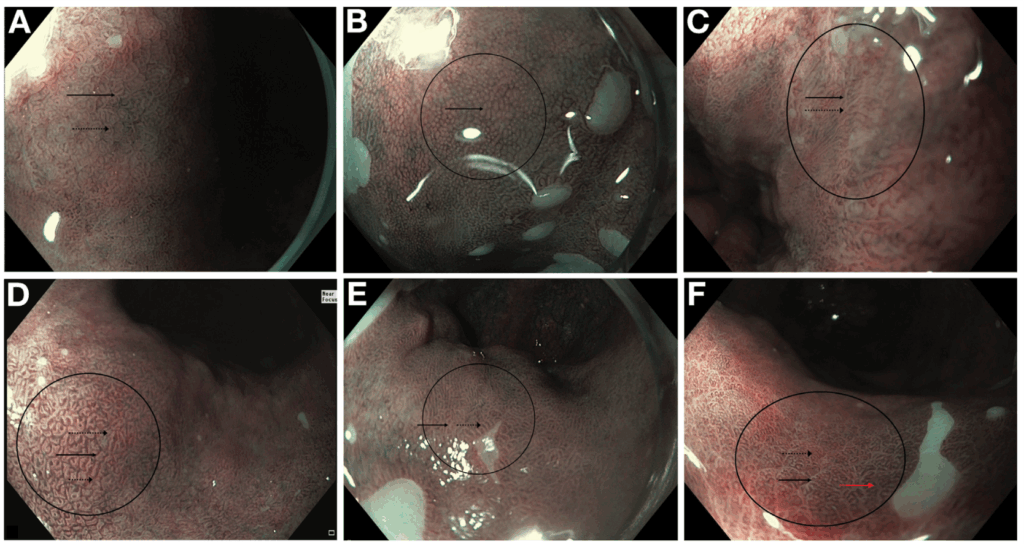
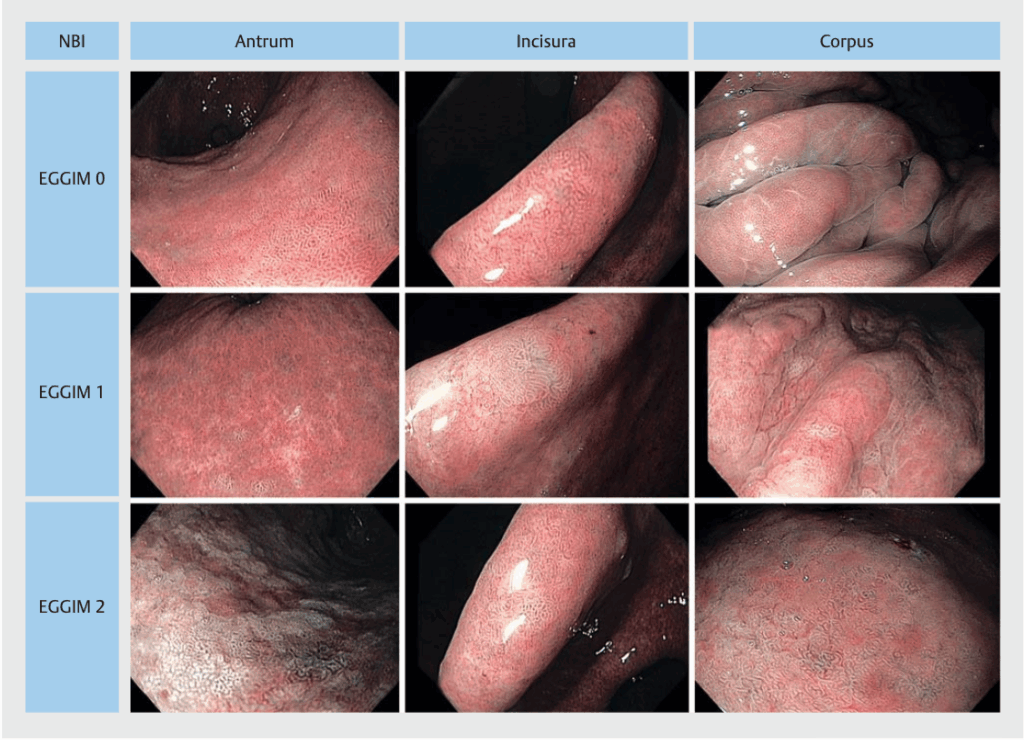
São avaliadas 5 áreas do estômago:
- Curvatura menor e maior do antro
- Curvatura menor e maior do corpo
- Incisura angular
Cada área recebe um escore de:
- 0 = ausência de GIM
- 1 = GIM focal (≤30% da área)
- 2 = GIM extensa (>30% da área)
- Escore total varia de 0 a 10.
Aplicação
Cutoff validado: EGGIM ≥5 → correlaciona-se fortemente com OLGIM III/IV (sensibilidade 89% e especificidade 95%)
Impacto prático:
- Escore com uso recomendando por guidelines internacionais.
- Pacientes com EGGIM ≥5 → candidatos a vigilância endoscópica periódica (segundo ESGE/MAPS).
Referências
Esposito G, Pimentel-Nunes P, Angeletti S, et al. Endoscopic grading of gastric intestinal metaplasia (EGGIM): a multicenter validation study. Endoscopy. 2018;50(9): 901–909. doi:10.1055/a-0808-3186
Dinis-Ribeiro M, Libânio D, Uchima H, Spaander MCW, Bornschein J, Matysiak-Budnik T, Tziatzios G, Santos-Antunes J, Areia M, Chapelle N, Esposito G, Fernandez-Esparrach G, Kunovsky L, Garrido M, Tacheci I, Link A, Marcos P, Marcos-Pinto R, Moreira L, Pereira AC, Pimentel-Nunes P, Romanczyk M, Fontes F, Hassan C, Bisschops R, Feakins R, Schulz C, Triantafyllou K, Carneiro F, Kuipers EJ. Management of epithelial precancerous conditions and early neoplasia of the stomach (MAPS III): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG) and European Society of Pathology (ESP) Guideline update 2025. Endoscopy. 2025 May;57(5):504-554. doi: 10.1055/a-2529-5025. Epub 2025 Mar 20. PMID: 40112834.