Cáncer Gástrico Hereditario
La mayoría de los casos de cáncer gástrico (CG) son esporádicos, pero alrededor del 10% presentan agregación familiar y del 1 al 3% tienen una causa hereditaria. El conocimiento de las síndromes hereditarias como factor causal del cáncer colorrectal (CCR) es bien difundido, pero en el CG esto es menos divulgado, hecho que puede perjudicar el diagnóstico precoz y el seguimiento adecuado.
El CG hereditario puede ocurrir asociado a presencia de poliposis o no, como en el caso de las síndromes de Cáncer Gástrico Difuso Hereditario, Li-Fraumeni, BRCA1, BRCA2 y Lynch. En este artículo describiremos brevemente las principales síndromes de CG hereditario asociadas a poliposis dejando las no asociadas para un artículo futuro.
1. CG HEREDITARIO ASOCIADO A POLIPOSIS
1.1 POLIPOSIS ADENOMATOSA FAMILIAR (PAF)
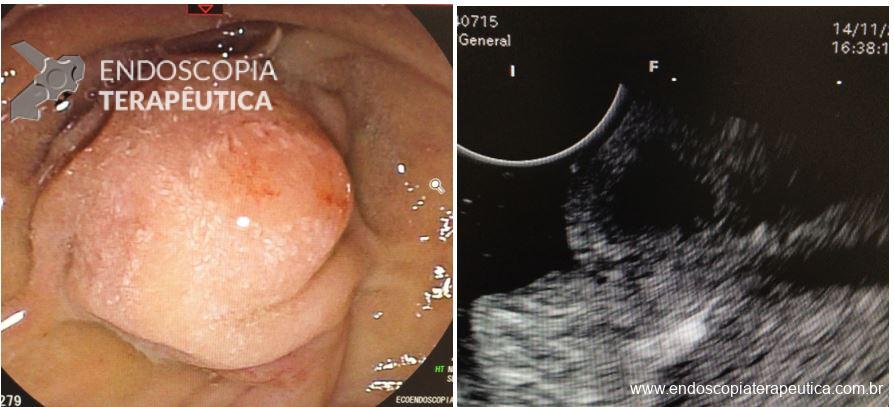
La PAF resulta de una mutación del gen supresor tumoral del gen APC causando un altísimo riesgo de CCR.
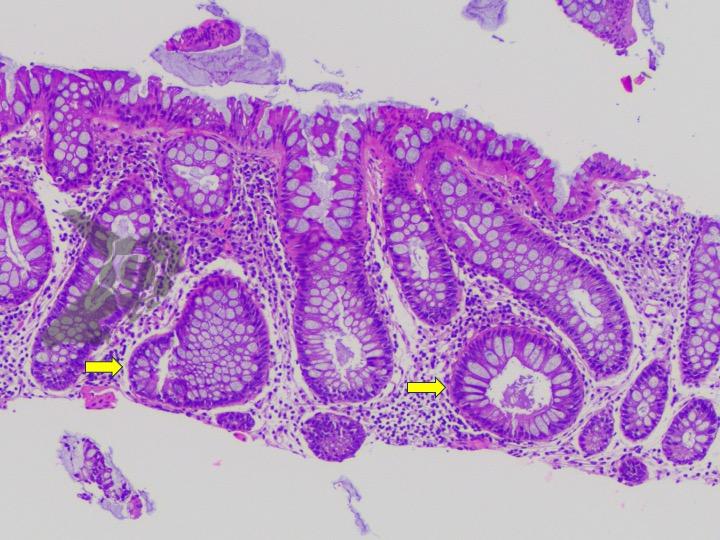
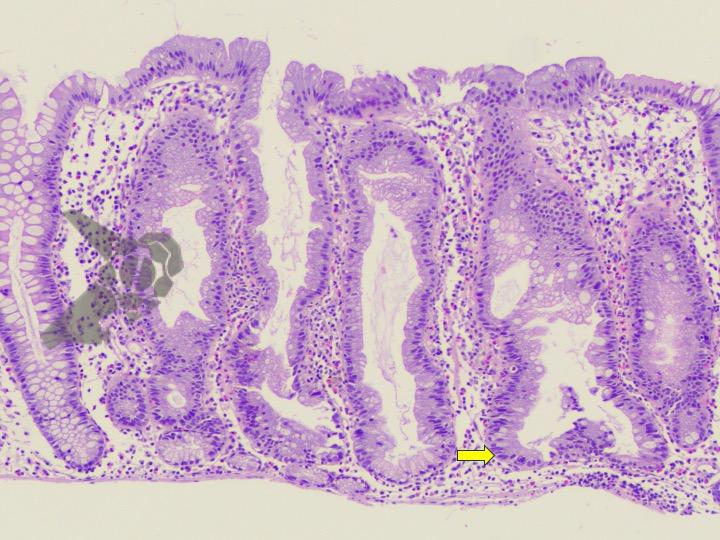
Aproximadamente del 51 al 88% de los pacientes presentan pólipos gástricos principalmente de glándulas fúndicas (PGF). La incidencia es elevada incluso en la PAF atenuada. Suelen ser numerosos, y el término poliposis gástrica puede ser empleado solo cuando más de 20 están presentes.
Displasia de bajo grado puede estar presente en hasta el 44% de los pólipos de glándulas fúndicas. Pólipos adenomatosos son detectados en cerca del 20% de los pacientes con PAF.
El rastreo endoscópico alto es recomendado en el momento de la manifestación de la poliposis colónica o a partir de los 25 años. El intervalo de realización va a depender de los hallazgos y también de acuerdo con la necesidad de seguimiento de adenoma de papila, cuando presente, de acuerdo con el escore de Spigelman.
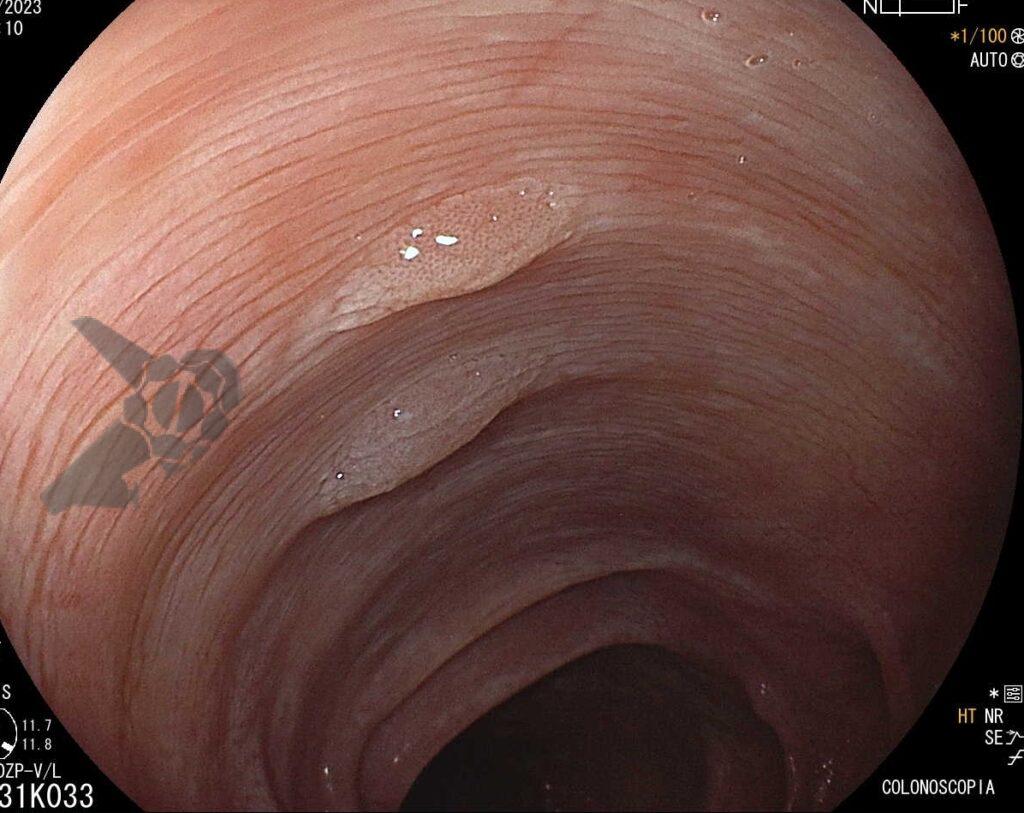
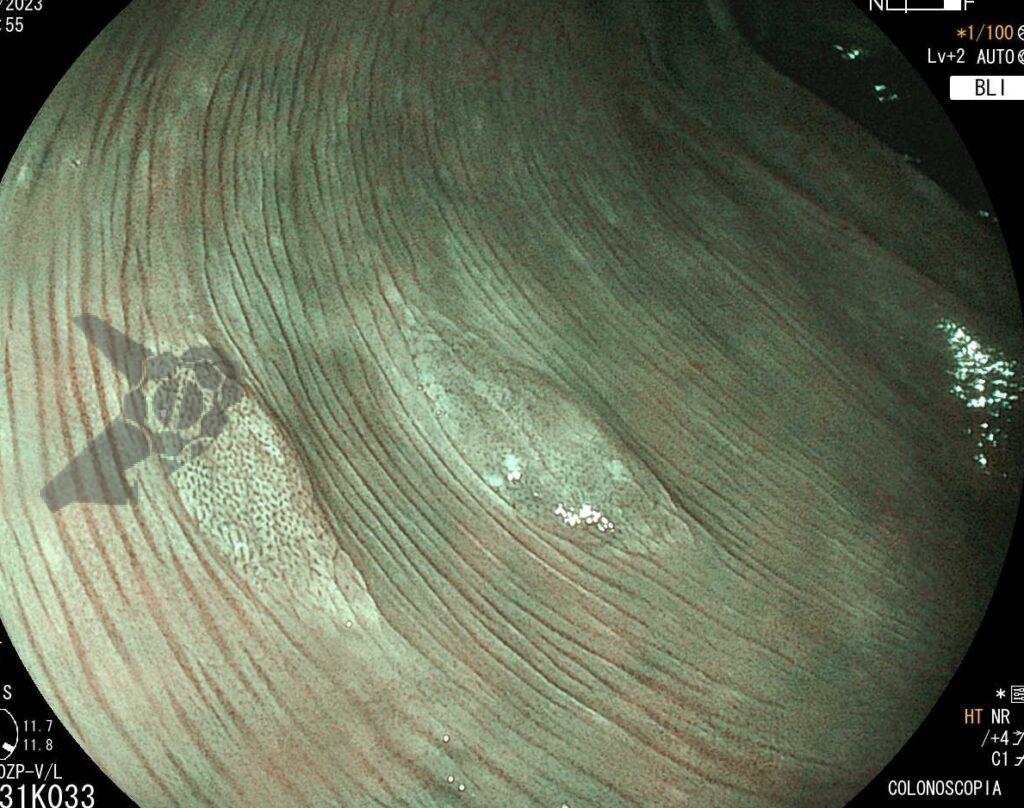
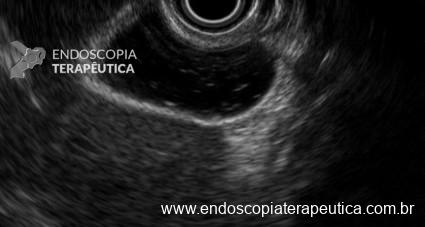
 Poliposis gástrica en paciente con PAF. Imágenes muestran innumerables pólipos en cárdia, fondo, cuerpo y antro.
Poliposis gástrica en paciente con PAF. Imágenes muestran innumerables pólipos en cárdia, fondo, cuerpo y antro.1.2 SÍNDROME DE PEUTZ-JEGHERS (SPJ)
La SPJ es autosómica dominante, caracterizada por el desarrollo de poliposis hamartomatosa gastrointestinal principalmente en el yeyuno asociada a la presencia de máculas melanocíticas.
El diagnóstico clínico se basa en la confirmación de la presencia de pólipos hamartomatosos asociado con historia familiar positiva e hiperpigmentación de mucosas, dedos y genitales externos.
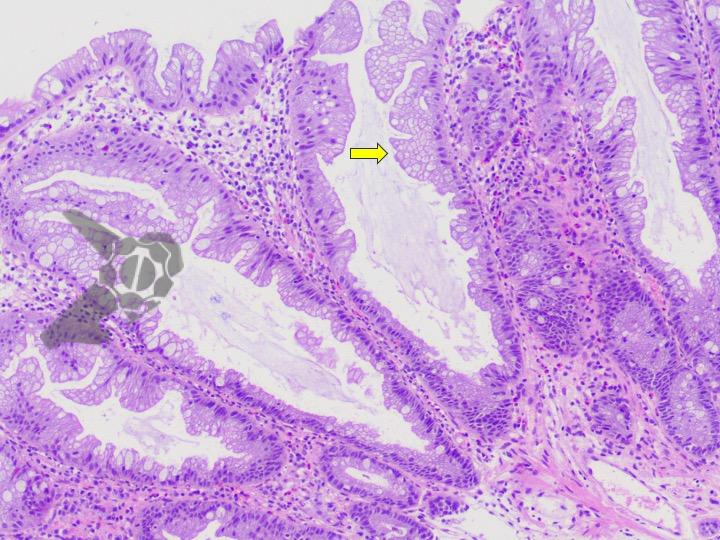
Pólipos gástricos son detectados en el 25% de los casos, comparados con el 70-90 % encontrados en el intestino delgado y el 50% en el colon. El aspecto morfológico del pólipo gástrico en la SPJ se asemeja a un patrón velloso proliferación epitelial hiperplásica siendo difícil distinguir del pólipo juvenil e hiperplásico.
Displasia es raramente detectada en los pólipos pero individuos con SPJ tienen un 29% de riesgo de desarrollar CG principalmente del tipo intestinal.
El rastreo debe ser iniciado precozmente en la infancia con endoscopia inicial con periodicidad dependiendo de los hallazgos. A partir de los 50 años, el riesgo de CG aumenta y la periodicidad debe ser más frecuente entre 1 a 2 años.
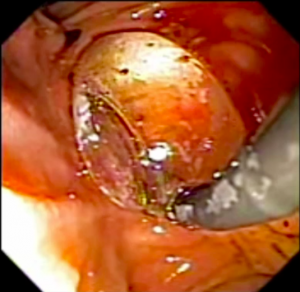
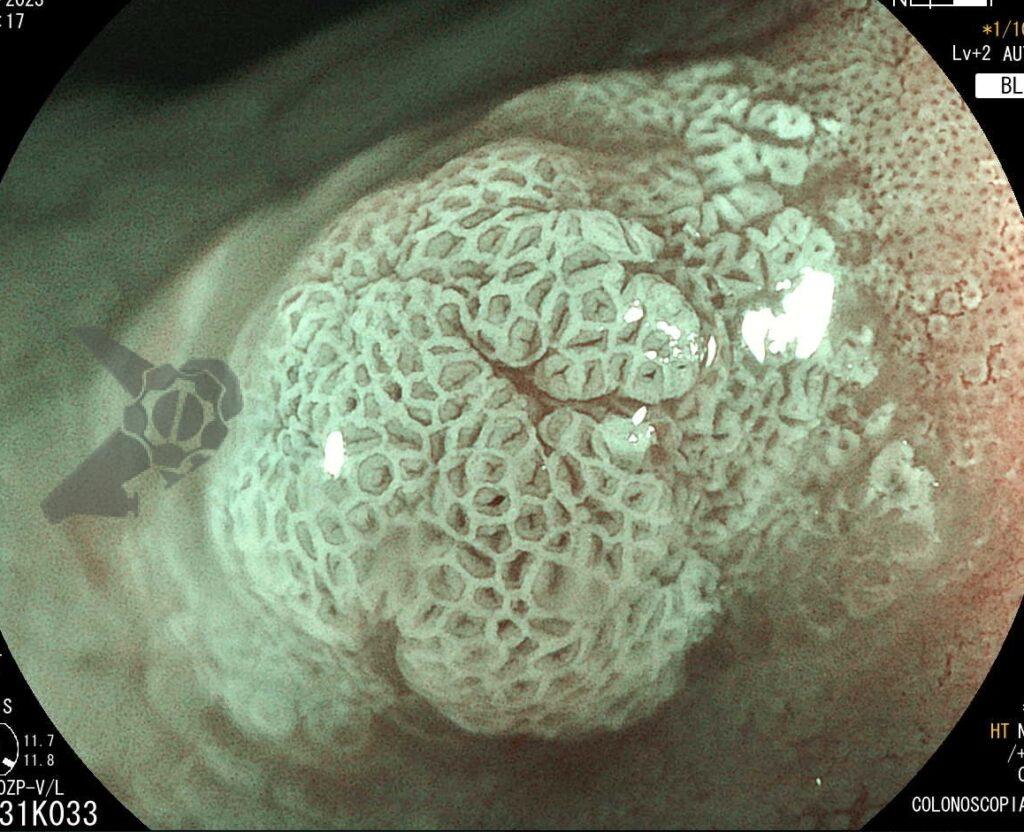
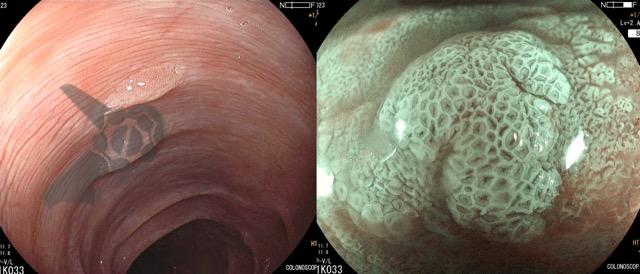
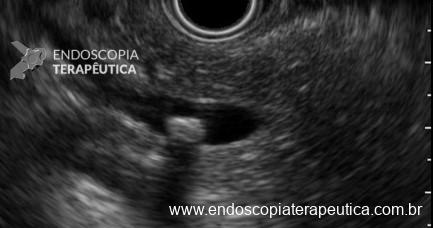
 Secuencia de imagen mostrando pólipo en región de cuerpo gástrico en paciente con Síndrome de Peutz-Jeghers, imágenes inferiores con magnificación de imagen.
Secuencia de imagen mostrando pólipo en región de cuerpo gástrico en paciente con Síndrome de Peutz-Jeghers, imágenes inferiores con magnificación de imagen.1.3 SÍNDROME DE POLIPOSIS JUVENIL
Síndrome autosómico dominante que lleva al desarrollo de pólipos en todo el tracto gastrointestinal principalmente en el colon y recto.
Criterios para sospecha clínica del síndrome incluyen más de 5 pólipos juveniles colorrectales, pólipos juveniles a lo largo del tracto gastrointestinal o más de 1 pólipo juvenil con historia familiar positiva. El diagnóstico definitivo se realiza de uno de los criterios de sospecha clínica en presencia de los genes BMPR1A y SMAD4 en la prueba genética.
Los pólipos juveniles son pólipos hamartomatosos que se desarrollan a partir de un tejido normal del tracto gastrointestinal. El aspecto endoscópico habitualmente es de un pólipo pediculado, multilobulado, suave variando desde pequeños pólipos hasta pólipos gigantes. En hasta el 75% de los casos existen otros tipos de pólipos en conjunto. La poliposis gástrica severa puede ocurrir causando anemia, hematemesis, enteropatía con pérdida proteica y síntomas obstructivos. La progresión a CG ocurre en hasta el 21% de los casos con una media de edad de 58 años.
El rastreo endoscópico es recomendado a partir de la adolescencia con endoscopias anuales.

1.4 POLIPOSIS ASOCIADA AL MUTYH (MAP)
MAP es una síndrome rara, autosómica recesiva, asociada con mutación en el gen MUTYH que participa de procesos de reparo de ADN. Pacientes con MAP tienen predisposición para el CCR, mama y ovario.
Pólipos gástricos son detectados en cerca del 10 al 33% de los casos y la mayoría son adenomas y PGF.
El riesgo de CG es bajo (2%) pero ocurre en pacientes más jóvenes (media de 38 años). Por otro lado, el riesgo de cáncer duodenal es alto pudiendo ocurrir en el 17% de los casos.
1.5 ADENOCARCINOMA GÁSTRICO CON POLIPOSIS PROXIMAL (GAPPS)
Esta síndrome se caracteriza por el desarrollo de una poliposis gástrica proximal incluyendo el fondo y cuerpo formando una alfombra de pequeños pólipos usualmente menores que 1 cm. El tipo histológico de los pólipos es variado pudiendo ser PGF, hiperplásico, adenomas y mixtos.
Los criterios para diagnóstico clínico incluyen detección de más de 100 pólipos o más de 30 pólipos con historia familiar positiva en pariente de primer grado, pólipos restringidos al cuerpo y fondo sin la presencia de pólipos colorrectales, morfología de PGF con áreas de displasia o carcinoma, exclusión de otras síndromes y uso de inhibidor de bomba de protones.
Serie de casos reportaron incidencia de 12,7% de CG, todos del tipo intestinal.
El seguimiento endoscópico debe ser realizado, pero en casos con múltiples pólipos la evaluación de pólipos con señales de degeneración puede quedar perjudicada siendo indicada la gastrectomía total.
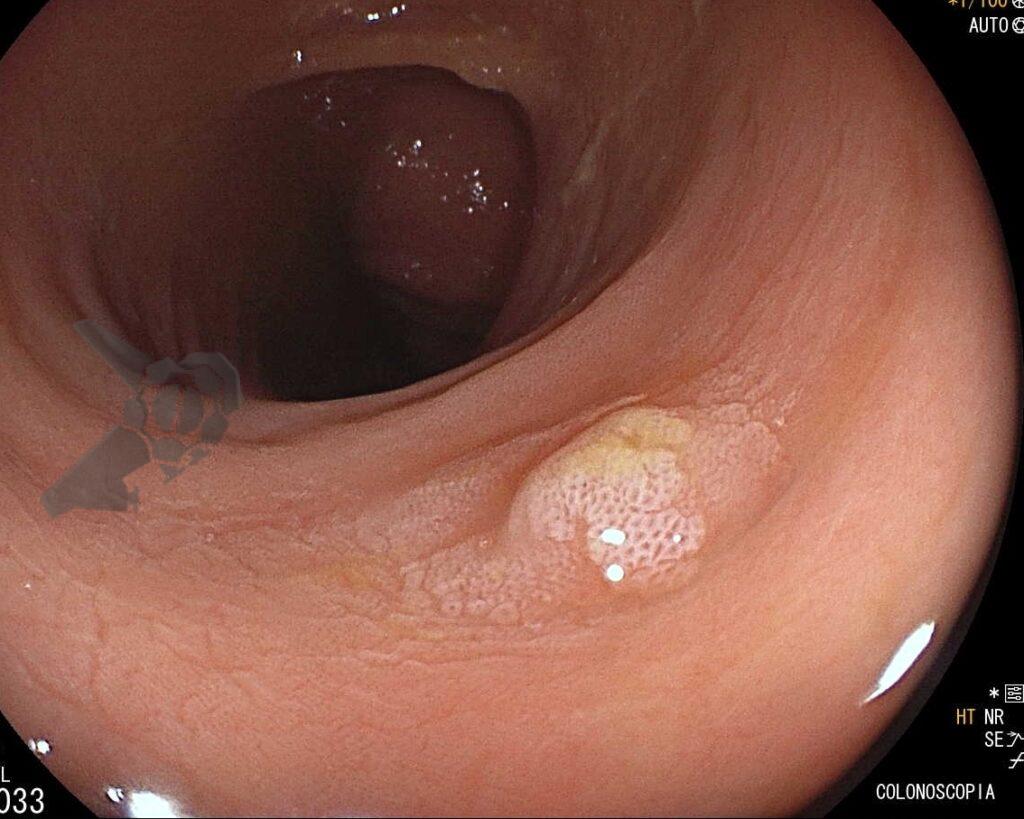
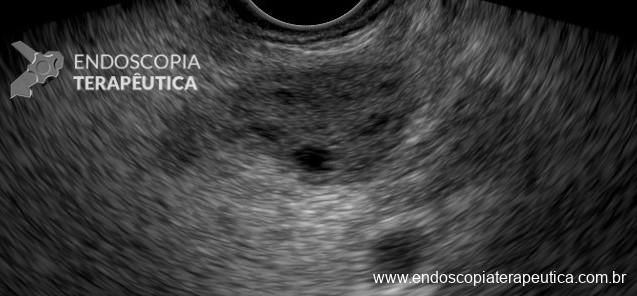
 Imágenes de GAPPS evidenciando afección de cuerpo y fondo con disminución progresiva en el número de pólipos en el estómago distal.
Imágenes de GAPPS evidenciando afección de cuerpo y fondo con disminución progresiva en el número de pólipos en el estómago distal. Tabla con resumen de las principales características de las síndromes genéticas relacionadas con el cáncer gástrico hereditario, dividiéndolas en asociadas y no asociadas a poliposis del tracto gastrointestinal.
Tabla con resumen de las principales características de las síndromes genéticas relacionadas con el cáncer gástrico hereditario, dividiéndolas en asociadas y no asociadas a poliposis del tracto gastrointestinal.Referencias
- Clauditz TS, Moore M, Setia N, et al. Syndromic gastric polyposis and hereditary gastric cancers. Diagnostic Histopathologic 2019; 26(1):39-46.
- Mahon SM. Hereditary Polyposis Syndromes. Gentics and Genomics 2018; 22(2): 151-6
- Cardoso DM. Síndromes de polipose colorretal. Endoscopia Terapêutica; 2020. Disponible en: http://endoscopiaterapeutica.com.br/assuntosgerais/sindromes-de-polipose-colorretal/
Cómo citar este artículo
Kodama, MFKP y Simoes IBP. Cáncer gástrico hereditario. Gastropedia 2025. Disponible en: https://endoscopiaterapeutica.net/es/temas-generales/cancer-gastrico-hereditario/