Efecto del cierre profiláctico con clips sobre el sangrado tardío tras la resección mucosa endoscópica del colon proximal: ensayo controlado aleatorizado multicéntrico (CLIPPER)
Publicado en Endoscopy en octubre 2025
Referencia: Turan AS, Moons LMG, Schreuder RM, Schoon EJ, Terhaar Sive Droste JS, Schrauwen RWM, Straathof JW, Bastiaansen BAJ, Schwartz MP, Hazen WL, Alkhalaf A, Allajar D, Hadithi M, van der Spek BW, Heine DGDN, Tan ACITL, de Graaf W, Boonstra JJ, Voogd FJ, Roomer R, de Ridder RJJ, Kievit W, Siersema PD, Didden P, van Geenen EJM; Dutch EMR Study Group. Clip placement to prevent delayed bleeding after colonic endoscopic mucosal resection (CLIPPER): study protocol for a randomized controlled trial. Trials. 2021 Jan 18;22(1):63. doi: 10.1186/s13063-020-04996-7. PMID: 33461579; PMCID: PMC7813164.
Introducción
El sangrado es la complicación más frecuente post-mucosectomía, con una incidencia del 3 al 7% (1-4). Una de las principales formas de prevenir este evento adverso es el cierre del lecho con clips, sin embargo, los resultados en la literatura son controvertidos. Una revisión sistemática y metaanálisis mostró que el cierre rutinario del lecho con clips no previene el sangrado (5), pero un estudio aleatorizado australiano reveló resultados discrepantes (6). Este estudio fue diseñado para evaluar el impacto del cierre sistemático del lecho de mucosectomía de lesiones grandes en el colon proximal.
Métodos
El CLIPPER es un estudio aleatorizado multicéntrico alemán, de superioridad, que incluyó a 356 pacientes sometidos a mucosectomía de lesiones/pólipos no pediculados > 20 mm proximales al colon descendente entre 2018 y 2021. Se excluyeron lesiones con manipulación previa, múltiples en el mismo paciente, sospecha de malignidad (Kudo V), sin elevación (non-lifting), o asociadas a inflamación activa (ejemplo: enfermedad inflamatoria) o comorbilidades graves (ASA IV-V).
Todos los casos fueron sometidos a inyección submucosa y resección con asa diatérmica (mucosectomía convencional). Hubo variación (discreción del endoscopista) en el tipo de asa, configuraciones de la unidad electroquirúrgica y solución inyectada. La aleatorización ocurría inmediatamente después de la mucosectomía, considerando los criterios de inclusión.
Grupo control: coagulación de los márgenes a criterio del endoscopista; manejo de anticoagulantes conforme a la guía alemana (7). Intervención (cierre del lecho): cierre sistemático del lecho con clips, siendo la distancia entre ellos de hasta 0,5 a 1 cm.
Se realizó un examen de control a los 6 meses, con evaluación endoscópica y biopsias de rutina. Ante la sospecha de recidiva, la resección se realizaba en el mismo procedimiento. La definición de recidiva se consideró a partir del anatomopatológico de las biopsias o resección.
El resultado primario fue la incidencia de sangrado tardío (evaluado por intención de tratamiento), definido como sangrado en las heces asociado a la necesidad de atención en emergencia, transfusión, prolongación de la internación/re-internación, intervención (endoscópica, endovascular o cirugía). Los sangrados autolimitados y ambulatorios no fueron considerados.
Resultados secundarios: tasa de cierre completo, síndrome post-polipectomía y gravedad del sangrado tardío.
El equipo que evaluaba a los pacientes ambulatoriamente estaba cegado en relación al grupo de aleatorización.
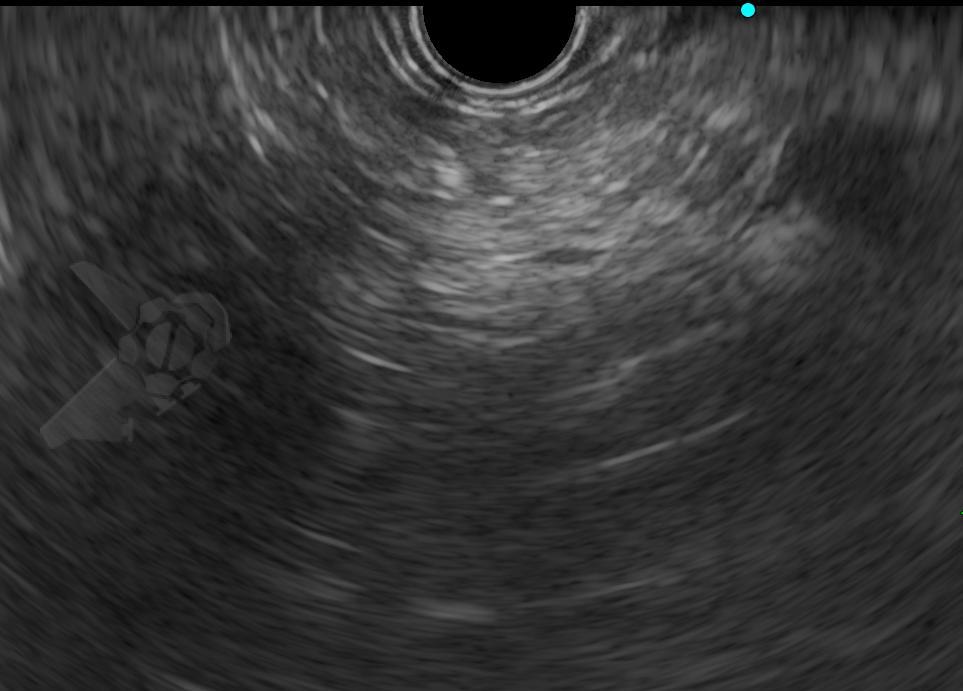
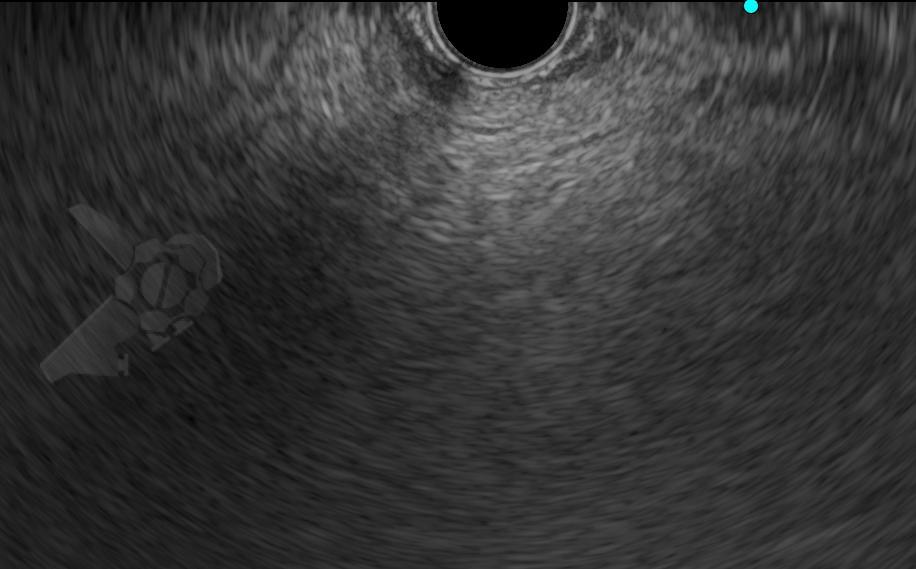
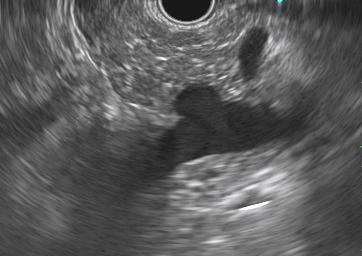
Imágenes ilustrativas
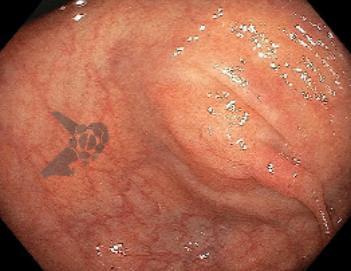
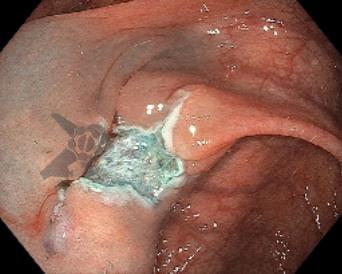
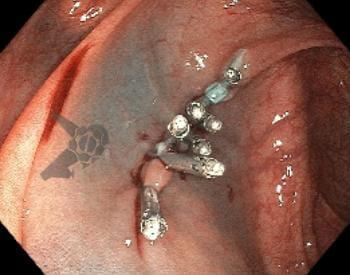
Resultados
Se incluyeron 356 pacientes, siendo 177 en el grupo del cierre profiláctico (intervención) y 179 en el control. El tamaño promedio de los pólipos fue de 30 mm (20-60 mm) y no hubo diferencia en las características basales de los pacientes.
El sangrado tardío ocurrió en 16 casos (9%) en la intervención (cierre del lecho) y 11 (6,1%) en el grupo control, lo que no presentó diferencia con relevancia estadística (p=0,3). Todos los casos fueron leves (n=11) o moderados (n=16) y ocurrieron hasta 12 días después de la resección (11 casos fueron en las primeras 24h). De estos casos, 16 no necesitaron reintervención, 1 precisó transfusión y 10 fueron sometidos a nueva colonoscopia (9 terapéuticas: 4 en el grupo del cierre y 5 en el grupo control). Ningún caso fue sometido a cirugía o arteriografía.
El tiempo de procedimiento fue mayor en el grupo del cierre (promedio en minutos 47 x 39, p=0,01).
Perforación (1/0,6% x 2/1,1%; p=0,6) y síndrome post-polipectomía (3/1,7% x 0; p=0,08) también fueron similares entre los grupos. En el grupo del cierre con clips, fue posible realizar el cierre completo en 125 casos, parcial en 46 y falla en 3, con tasas de sangrado de 4,8% (6/125), 19,6% (9/46) y 33,3% (⅓), respectivamente.
En el análisis univariado, se consideraron factores de riesgo para sangrado tardío: localización en el ciego (p=0,03) y uso de anticoagulantes (p<0,01). Tamaño > 40 mm, sangrado intra-procedimiento, cierre completo con clips, uso de antiplaquetarios no presentaron relevancia estadística.
Discusión
Los resultados de este estudiono confirmaron el efecto protector del cierre profiláctico del lecho de lesiones de colon proximal para el sangrado tardío, con clips, demostrado en trabajos previos (9-12).
Algunas hipótesis fueron postuladas por los autores, incluyendo:
(I) posibilidad de sobreestimación de los casos de cierre parcial en relación con el fallo del cierre,
(II) rendimiento de los clips utilizados (Quick Clip Pro),
(III) inclusión de endoscopistas no habituados a cierres complejos y
(IV) inclusión de menor cantidad de pacientes de alto riesgo.
Entre las limitaciones del estudio, se encuentran:
(I) inclusión de endoscopistas con menor experiencia en mucosectomías complejas y ausencia de control de este dato,
(II) inclusión después de la mucosectomía pudiendo generar sesgo de selección al excluir lechos de difícil cierre,
(III) inclusión de centros académicos y no académicos, y
(IV) documentación insatisfactoria para la revisión de los criterios para considerar cierre parcial o fallo.
Cabe señalar, además, la ausencia de análisis de la modalidad de corriente eléctrica empleada: considerando que el corte en frío tiene una tasa de sangrado tardío casi nula, es posible que el corte puro y menores proporciones de coagulación en corrientes mixtas presenten un efecto protector para el sangrado.
Otro punto que aún merece mayor investigación es la posibilidad de que el cierre completo sea beneficioso, pero la manipulación sin lograr el éxito en el cierre podría aumentar la tasa de sangrado tardío. Esto también refuerza los diferentes resultados según la experiencia del profesional que realiza el procedimiento.
De cualquier forma, los hallazgos son interesantes ya que pueden demostrar la realidad heterogénea en la práctica (centros académicos y no académicos; experiencia variable de profesionales; diferentes materiales).
El hecho de que los autores busquen más motivos para comprender la ausencia de beneficio de la intervención demuestra su creencia en los resultados de trabajos previos de que existe un probable efecto beneficioso. Sin embargo, nuevos estudios y el análisis crítico de los trabajos ya publicados pueden ayudarnos mejor a comprender qué subgrupo de pacientes puede beneficiarse de la medida estudiada.
Referencias
- Kemper G, Turan AS, Schreuder RM, Schrauwen RWM, Hadithi M, Didden P, Bastiaansen BAJ, van der Spek BW, Droste JSTS, Schwartz MP, Hazen WL, Straathof JWA, Boonstra JJ, Alkhalaf A, Voogd FJ, Allajar D, de Graaf W, Koehestanie P, Roomer R, de Ridder RJJ, Moons LMG, Siersema PD, van Geenen EJM; Dutch EMR Study Group. The effect of prophylactic clipping on delayed bleeding after proximal colonic endoscopic mucosal resection: a multicenter, randomized controlled trial (CLIPPER). Endoscopy. 2025 Nov;57(11):1243-1250. doi: 10.1055/a-2637-3180. Epub 2025 Jul 22. PMID: 40695477.
- Bahin FF, Naidoo M, Williams SJ et al. Prophylactic endoscopic coagulation to prevent bleeding after wide-field endoscopic mucosal resection of large sessile colon polyps. Clin Gastroenterol Hepatol 2015; 13: 724–730.e1-2
- Burgess NG, Metz AJ, Williams SJ et al. Risk factors for intraprocedural and clinically significant delayed bleeding after wide-field endoscopic mucosal resection of large colonic lesions. Clin Gastroenterol Hepatol 2014; 12: 651–661.e1-3.
- Lee CK, Lee SH, Park JY et al. Prophylactic argon plasma coagulation ablation does not decrease delayed postpolypectomy bleeding. Gastrointest Endosc 2009; 70: 353–361.
- Metz AJ, Bourke MJ, Moss A et al. Factors that predict bleeding following endoscopic mucosal resection of large colonic lesions. Endoscopy 2011; 43: 506–511.
- Forbes N, Frehlich L, James MT et al. Routine prophylactic endoscopic clipping is not efficacious in the prevention of delayed post-polypectomy bleeding: a systematic review and meta-analysis of randomized controlled trials. J Can Assoc Gastroenterol 2019; 2: 105–117.
- Gupta S, Sidhu M, Shahidi N et al. Effect of prophylactic endoscopic clip placement on clinically significant post-endoscopic mucosal resection bleeding in the right colon: a single-centre, randomised controlled trial. Lancet Gastroenterol Hepatol 2022; 7: 152–160.
- Brouwer MA, van Hooft JE, Meijer K, Mundt MW, Peters FTM, Prins AJR, et al. Nederlandse Richtlijn Beleid antitrombotische therapie rondom endoscopische procedures. Nederlandse Vereniging van Maag-Darm-Leverartsen. 2016. Available from: https://www.mdl.nl/sites/www.mdl.nl/files/richlijnen/Richtlijn_antitrombotische_therapie_final_mei_2016.pdf.
- Albéniz E, Álvarez MA, Espinós JC, Nogales O, Guarner C, Alonso P, Rodríguez-Téllez M, Herreros de Tejada A, Santiago J, Bustamante-Balén M, Rodríguez Sánchez J, Ramos-Zabala F, Valdivielso E, Martínez-Alcalá F, Fraile M, Elosua A, Guerra Veloz MF, Ibáñez Beroiz B, Capdevila F, Enguita-Germán M. Clip Closure After Resection of Large Colorectal Lesions With Substantial Risk of Bleeding. Gastroenterology. 2019 Nov;157(5):1213-1221.e4. doi: 10.1053/j.gastro.2019.07.037. Epub 2019 Jul 27. PMID: 31362007.
- Pohl H, Grimm IS, Moyer MT, Hasan MK, Pleskow D, Elmunzer BJ, Khashab MA, Sanaei O, Al-Kawas FH, Gordon SR, Mathew A, Levenick JM, Aslanian HR, Antaki F, von Renteln D, Crockett SD, Rastogi A, Gill JA, Law RJ, Elias PA, Pellise M, Wallace MB, Mackenzie TA, Rex DK. Clip Closure Prevents Bleeding After Endoscopic Resection of Large Colon Polyps in a Randomized Trial. Gastroenterology. 2019 Oct;157(4):977-984.e3. doi: 10.1053/j.gastro.2019.03.019. Epub 2019 Mar 15. PMID: 30885778; PMCID: PMC8224988.
- Feagins LA, Smith AD, Kim D, Halai A, Duttala S, Chebaa B, Lunsford T, Vizuete J, Mara M, Mascarenhas R, Meghani R, Kundrotas L, Dunbar KB, Cipher DJ, Harford WV, Spechler SJ. Efficacy of Prophylactic Hemoclips in Prevention of Delayed Post-Polypectomy Bleeding in Patients With Large Colonic Polyps. Gastroenterology. 2019 Oct;157(4):967-976.e1. doi: 10.1053/j.gastro.2019.05.003. Epub 2019 May 31. PMID: 31158369.
- Forbes N, Gupta S, Frehlich L, Meng ZW, Ruan Y, Montori S, Chebaa BR, Dunbar KB, Heitman SJ, Feagins LA, Albéniz E, Pohl H, Bourke MJ. Clip closure to prevent adverse events after EMR of proximal large nonpedunculated colorectal polyps: meta-analysis of individual patient data from randomized controlled trials. Gastrointest Endosc. 2022 Nov;96(5):721-731.e2. doi: 10.1016/j.gie.2022.05.020. Epub 2022 Jun 3. PMID: 35667388.
Cómo citar este artículo
Funari MP, Penaloza CSQ. Efecto del cierre profiláctico con clips sobre el sangrado tardío tras la resección mucosa endoscópica del colon proximal: ensayo controlado aleatorizado multicéntrico (CLIPPER) Endoscopia Terapéutica 2026, Vol I. Disponible en: https://endoscopiaterapeutica.net/es/articulos-comentados/efecto-del-cierre-profilactico-con-clips-sobre-el-sangrado-tardio-tras-la-reseccion-mucosa-endoscopica-del-colon-proximal-ensayo-controlado-aleatorizado-multicentrico-clipper/