Más vale una mucosectomía de colon en piecemeal (EPMR) bien hecha, que un intento de mucosectomía en bloque (EMR) frustrado – ¡Consejos para realizarla sin miedos!
Caso de la vida real, que encontramos durante las agendas de Colonoscopia:
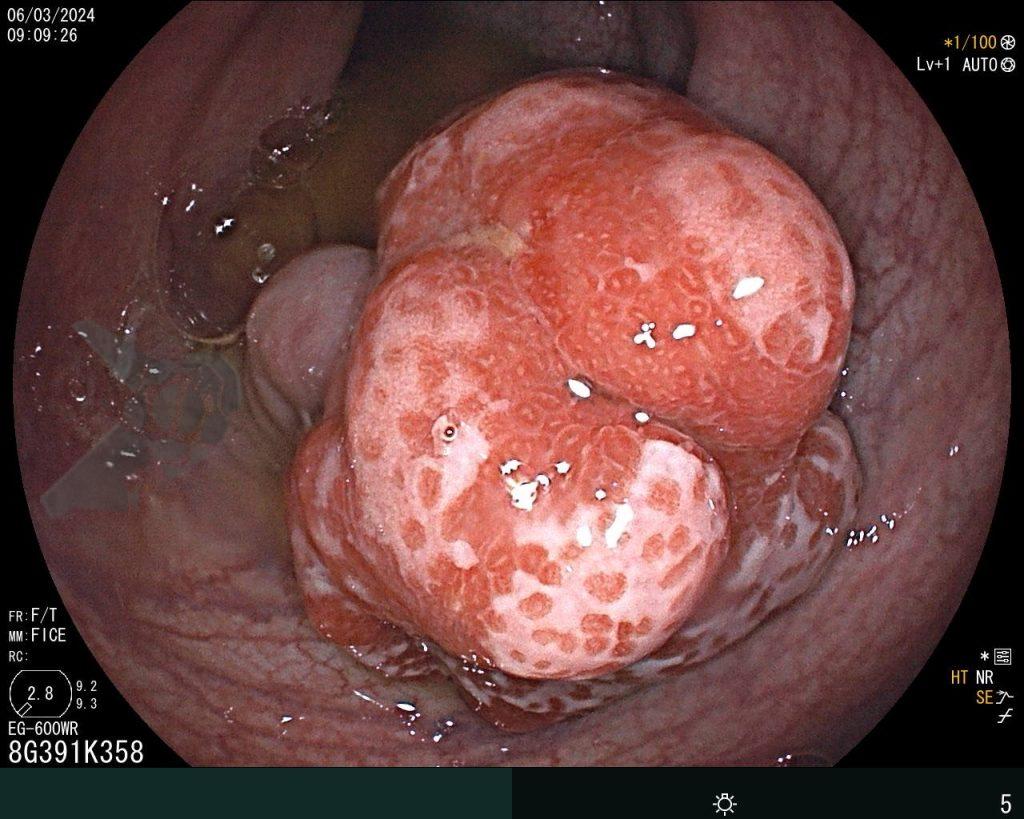
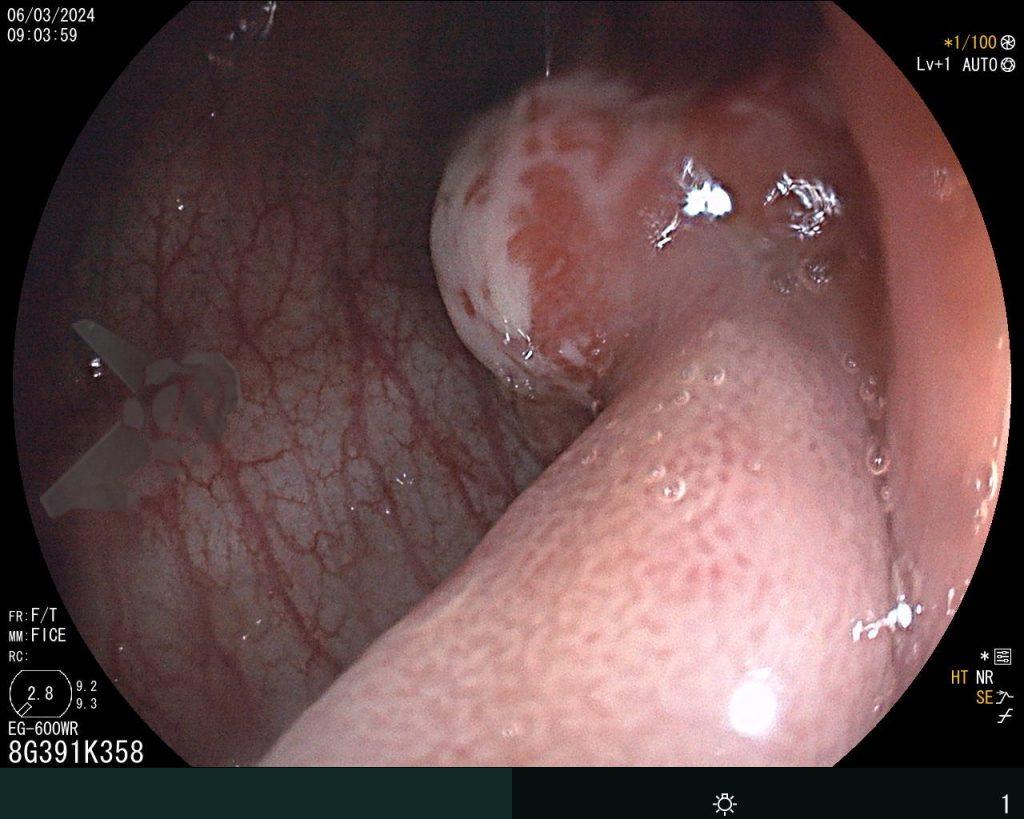
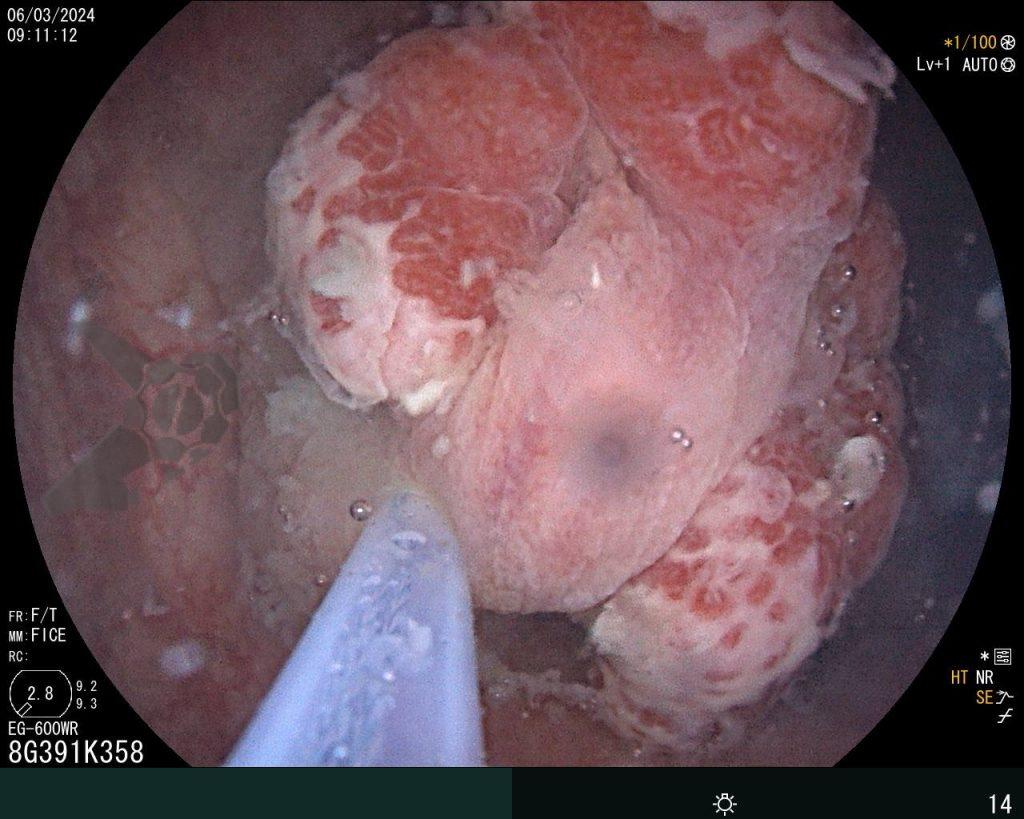
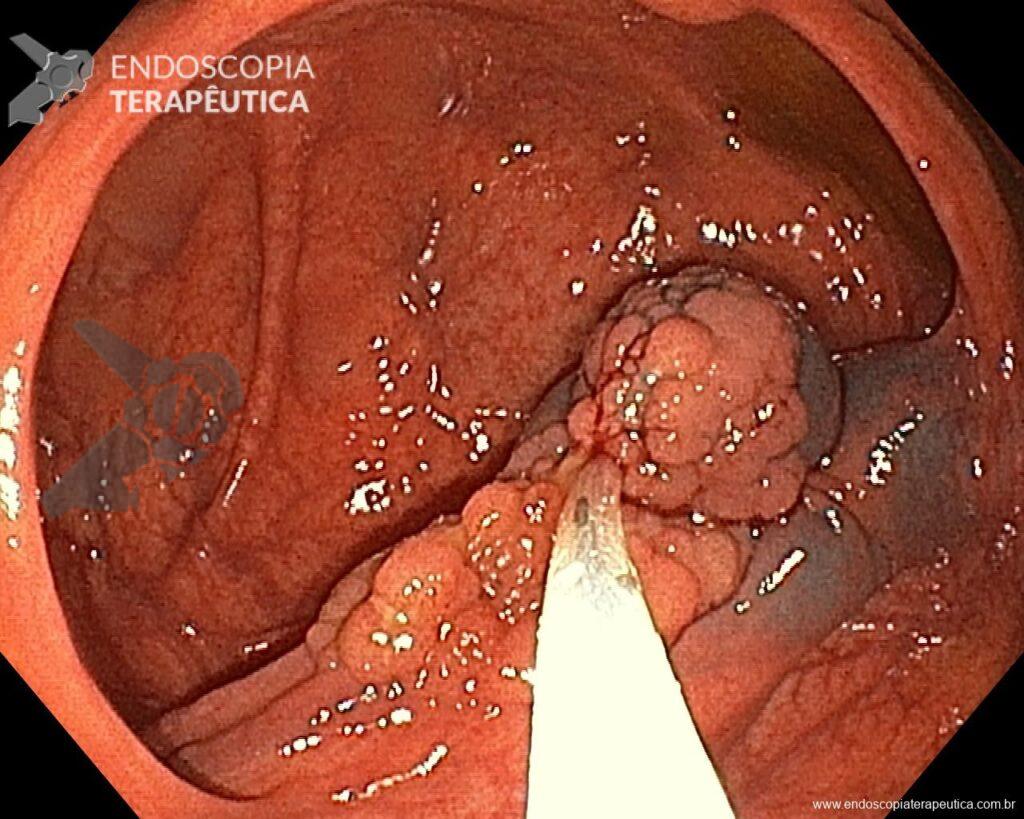
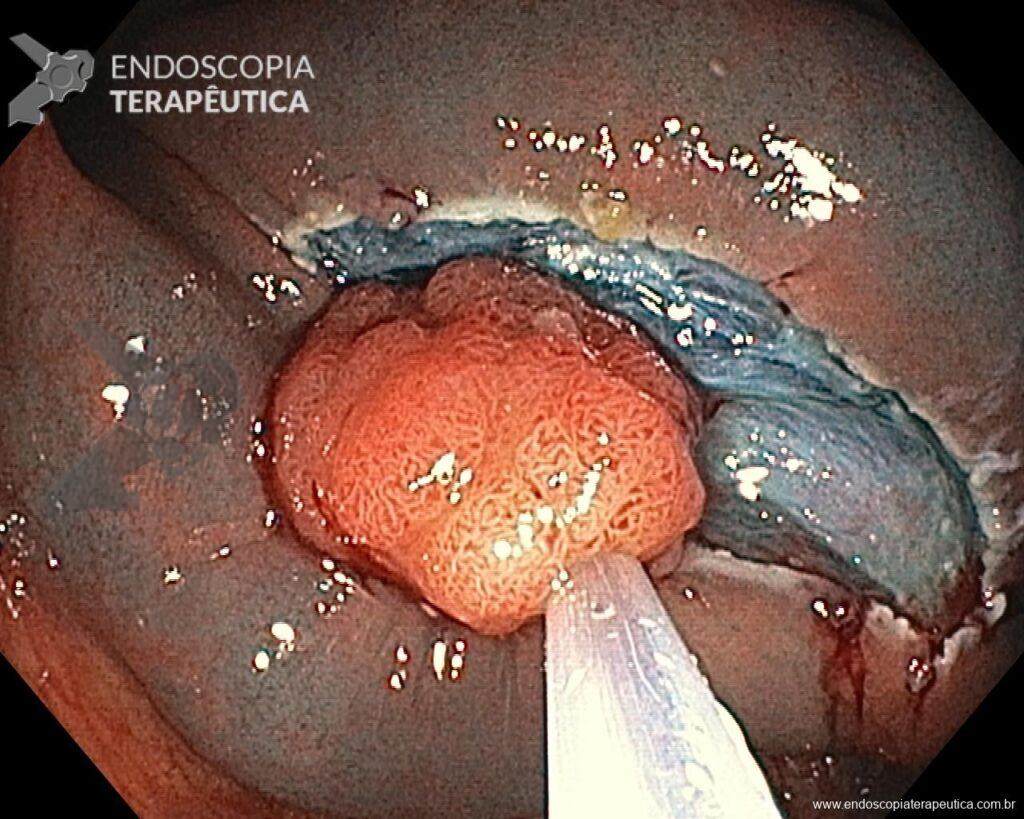
Hombre, 60 años, previamente sano, sin comorbilidades ni historial familiar relevante para neoplasias del tracto gastrointestinal, fue sometido a la primera colonoscopia para fines de rastreamiento/prevención del cáncer colorrectal obteniendo el siguiente hallazgo:
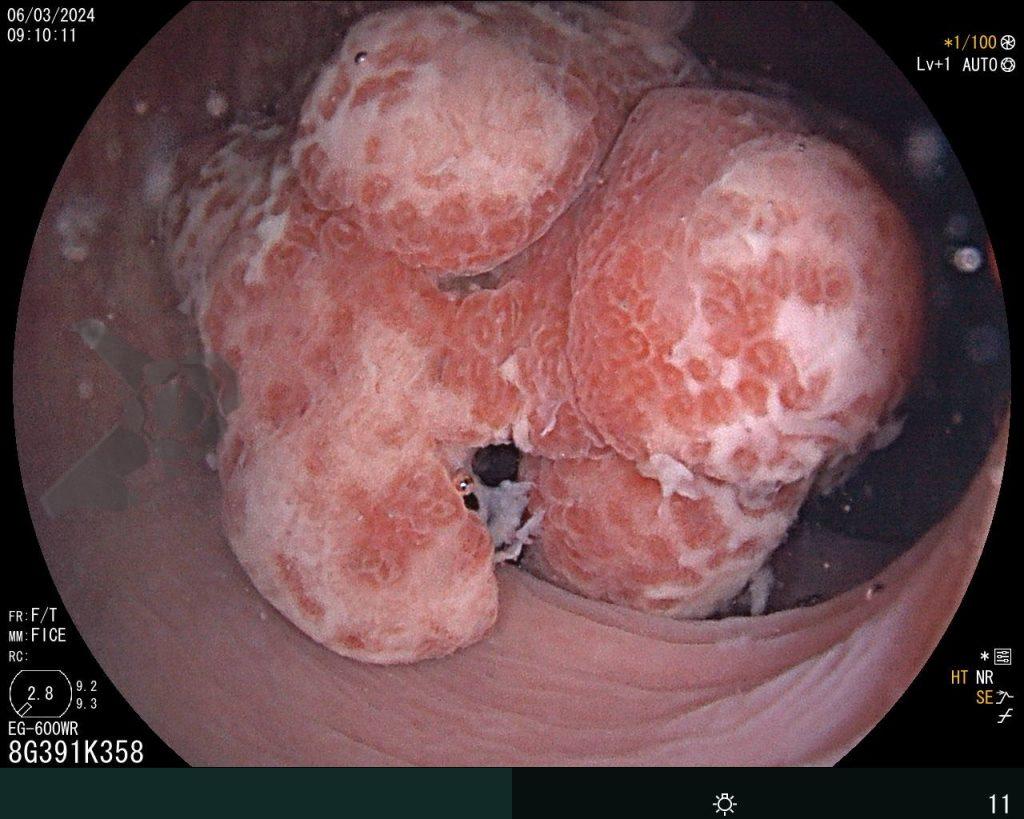
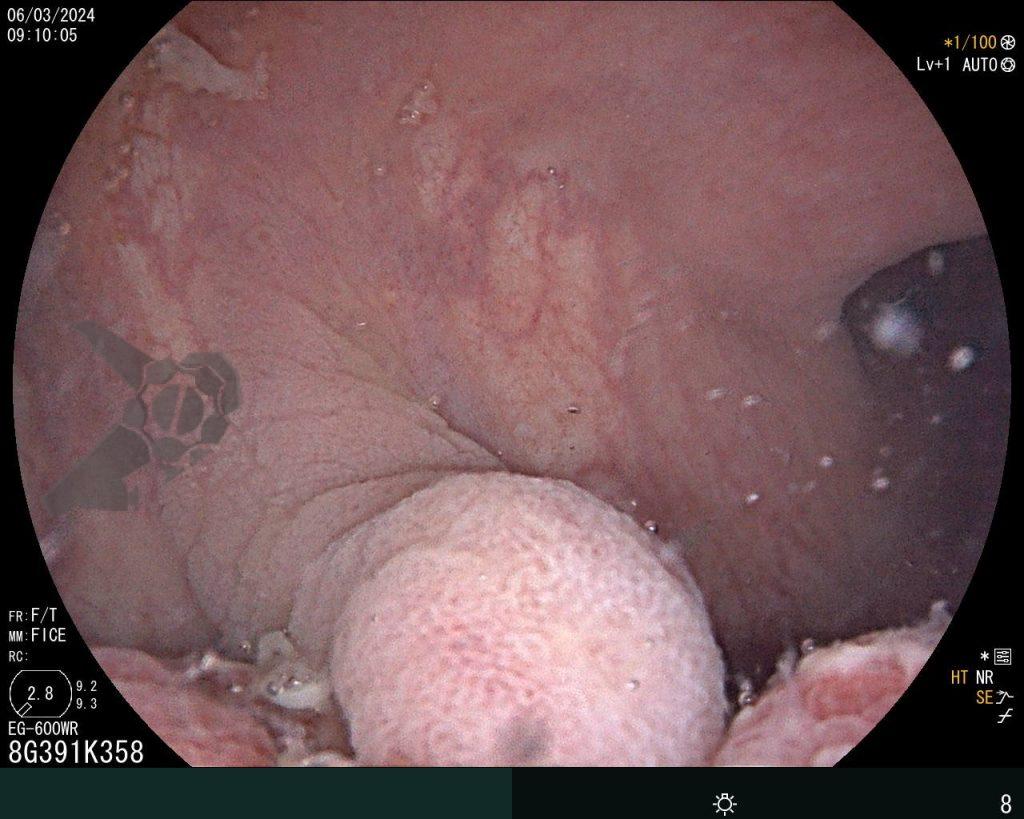
– Lesión plano-elevada de crecimiento lateral (LST), del tipo granular homogénea (LST-G-H), con superficie y vasculatura regulares a la cromoscopia virtual con NBI, midiendo cerca de 4cm, localizada en el ciego (París 0-IIa / JNET 2A).
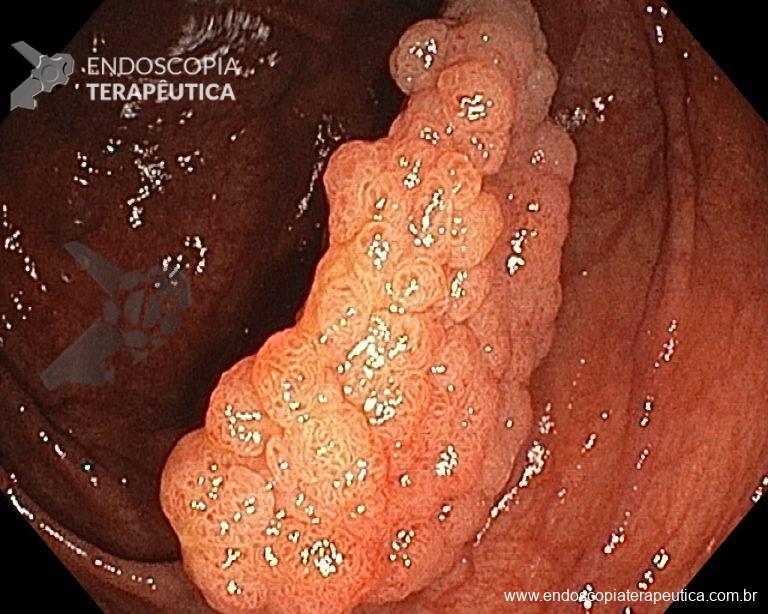
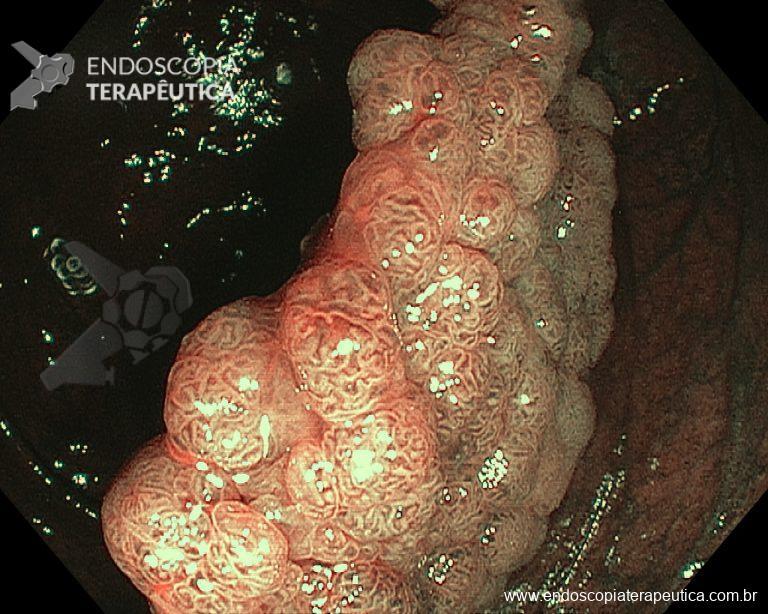
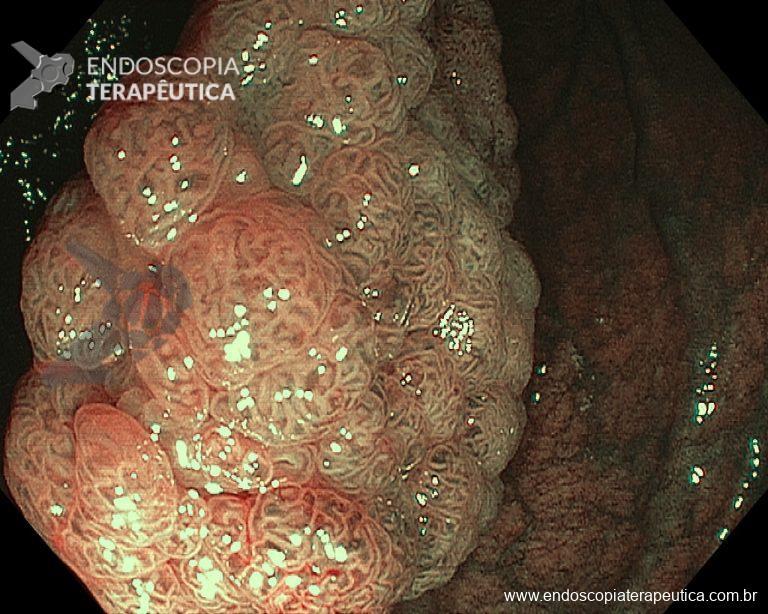
Ante una lesión de este tamaño es natural que surjan dudas acerca del tratamiento ideal a ser ofrecido al paciente, especialmente en aquellos que no dominan las técnicas avanzadas de resección endoscópica, sobre todo la Disección Endoscópica de la Submucosa (ESD).
Clasificación de las LST
- El término LST fue originalmente propuesto por Kudo et al y describe un patrón de crecimiento de tumores colorrectales de diámetro ≥10 mm, que tienden a esparcirse lateralmente con un menor eje vertical. Las LSTs pueden ser clasificadas en dos tipos: LST tipo granular (LST-G), con gránulos y nódulos en la superficie del tumor, y LST tipo no granular (LST-NG), con superficie plana y lisa. La primera puede ser subclasificada en dos: LST-G tipo homogénea (LST-G-H), con gránulos o nódulos distribuidos de manera uniforme en la superficie del tumor, y LST-G tipo nodular mixta (LST-G-M), con nódulos gruesos y de tamaños diferentes en la superficie; la segunda también es subclasificada en dos: LST-NG tipo pseudodeprimida (LST-NG-PD), cuando hay una depresión en el centro de la lesión, y tipo LST-NG plano-elevada (LST-NG- F), sin depresión, o sea, totalmente plana.
Prevalencia y localización de las LST
- La frecuencia estimada de las LSTs entre todos los tumores colorrectales epiteliales, excluyendo carcinomas avanzados, varía en la literatura, quedando en promedio 4,5%, sin embargo, estudios más recientes con mayor casuística apuntan a una prevalencia que puede alcanzar hasta 12,3%.
- Las LST-G son las más prevalentes, respondiendo por cerca de 65-70% de todas las LSTs. Mientras las LST-G-H tienden a localizarse más en el colon proximal, las LST-G-M acometen más el recto y usualmente alcanzan mayores diámetros. Ya las LST-NG son más comúnmente encontradas en el colon transverso.
LST x riesgo de malignidad
- Cada subtipo tiene características diferentes y únicas, lo que requiere una decisión sobre la política de tratamiento de forma individualizada.
- Más de la mitad de las lesiones LST-G-H son adenomas, siendo rara la presencia de carcinoma, aún cuando alcancen gran diámetro, sin embargo, incluso cuando presente, tiende a ser restringida a la mucosa (Tis – intramucoso).
- En cuanto a las LST-NG, aunque ambas, LST-NG-F y LST-NG-PD, sean consideradas como subtipo, la segunda posee mayor tasa de invasión submucosa incluso en tamaños pequeños, cuya naturaleza tiende a ser multifocal, inclusive es el subtipo de mayor riesgo entre todas las LSTs. Ya las LST-NG-F presentan bajo riesgo de invasión submucosa, y en los pocos casos presentes, tiende a ser focal.
LST x elección del tratamiento endoscópico
- La ESD es ampliamente utilizada en el tracto gastrointestinal superior, sin embargo, debido a las diferencias anatómicas e histológicas entre el colon y el estómago, no está establecida como la técnica terapéutica estándar para tumores colorrectales. Además, es fundamental tener en cuenta, incluso a pesar de los avances en los últimos años, que la técnica de ESD aún es bastante escasa en la mayor parte de los centros médicos, de forma que la elección de la técnica de tratamiento endoscópico no puede causar más dificultades que el problema en sí.
- Casi todas las LST-G-H no invaden la submucosa. A pesar de ser mayor comparada con la ESD, cuando bien ejecutada, la tasa de recurrencia tras EPMR es baja, sin preocupaciones clínicas relevantes, visto que cuando ocurre es generalmente unifocal, diminuta y fácilmente tratada en una única sesión. Por lo tanto, en este tipo morfológico, EMR y EPMR pueden ser adoptadas como primera opción, sobre todo por su mayor perfil de seguridad.
- Debido a que las LST-NG-PD poseen la mayor tasa de invasión submucosa, incluso en tamaños pequeños, con una naturaleza invasiva más multifocal y con tendencia a mayor profundidad, independientemente si se observa solo en un lugar, la resección en bloque, principalmente por ESD, debe siempre ser considerada la primera opción para permitir una evaluación patológica más fidedigna.
- En cuanto a las LST-G-M, la mayoría de las invasiones submucosas ocurren debajo del mayor nódulo, sin embargo, en hasta 17,1% de ellas ocurren también focos de invasión fuera del nódulo dominante (invasión multifocal). Como este tipo morfológico es el que alcanza los mayores diámetros, la resección en bloque por EMR es frecuentemente considerada difícil. Por esas razones, cuando se opte por realizar EPMR, se hace necesario garantizar la resección del nódulo dominante en pieza única o proceder ESD, a fin de obtener diagnósticos patológicos precisos. Conviene recordar que las grandes LST-G-M se localizan más frecuentemente en el recto, donde tanto el perfil de seguridad como los desdoblamientos de un tratamiento endoscópico no curativo por imposibilidad de evaluación histológica (colostomía definitiva) favorecen la realización de ESD en detrimento de la EPMR.
- Las LST-NG-F presentan riesgo bien menor de invasión submucosa cuando comparadas a las LST-NG-PD, en algunas series hasta comparables al riesgo de las LST-G-H, por lo tanto, varias de aquellas lesiones pueden ser curadas por tratamiento endoscópico con EMR o EPMR. No obstante, como el tamaño de este tipo morfológico está asociado a una mayor posibilidad de invasión de la submucosa, especialmente cuando mayores que 30 mm de diámetro, la resección en bloque por ESD también puede ser adoptada si son difíciles de remover en bloque por EMR.
Consejos de oro para realizar una EPMR
1. Invertir tiempo suficiente evaluando la lesión a ser tratada.
Asegúrese de inspeccionar la lesión a ser resecada. Haga cuestión de pasar tiempo suficiente evaluando la morfología de la lesión de acuerdo con la clasificación de París, así como los patrones vasculares y glandulares. No es pérdida de tiempo, de hecho, ganará tiempo decidiendo la mejor forma de abordar la lesión! Preste atención en los márgenes, pues pueden extenderse más allá de la pliegue. Inspeccione la lesión con luz blanca de alta definición y cromoscopia convencional o virtual. Una evaluación minuciosa puede identificar lesiones con posible invasión de la submucosa y consecuentemente aquellos pacientes que se beneficiarán de la resección en pieza única.
2. No subestimar la relevancia de la posición de la lesión.
Tenga una buena posición con el aparato rectificado y relajado. Posicione la lesión entre 5 y 6 horas en el campo endoscópico. El aparato y el accesorio deben responder “uno a uno” a los movimientos de las manos, de los dedos y también de las ruedas. Trabajar en la mejor posición es extremadamente eficaz en minimizar los riesgos y maximizar el resultado de la resección. Si se está utilizando un endoscopio de rigidez variable, aproveche el potencial de retroflexión de la punta. Posicione al paciente de forma que cualquier fluido o pedazos resecados se acumulen lejos de la lesión, para que el campo de trabajo se mantenga limpio y la visión ideal esté preservada en caso de complicación.
3. Elegir bien la asa.
Dependiendo de la morfología o tamaño del pólipo, seleccionar el asa más adecuada puede hacer la diferencia en el éxito del procedimiento y, por lo tanto, en los resultados. Asas rígidas pequeñas (10–20 mm) o grandes (25–33 mm) que poseen hilo trenzado deben ser preferidas para EPMR y EMR en bloque, respectivamente. Por otro lado, asas monofilamentarias pueden ser la mejor opción para capturar lesiones que poseen dificultad en elevar, como recurrencia tras EMR o situaciones que ya hubo intento de resección previa. Use el aparato como una extensión de su mano, colocándolo paralelo a la pared. Adapte el corte al plano de la lesión, fragmento por fragmento. Cuanto más ángulo cree entre el asa y la pared, mayor la probabilidad de involucrar la muscular propia. Cierre bien el asa para mantener la lesión en su lugar antes de resecarla. Esté consciente de la posibilidad de fibrosis submucosa resultante de la recolección de biopsias anteriores, intentos de resección previa y LST-NG, pues en estas situaciones la aprehensión del asa puede ser difícil, eventualmente necesitando de técnicas alternativas para la remoción de la lesión
4. ¡No ser codicioso!
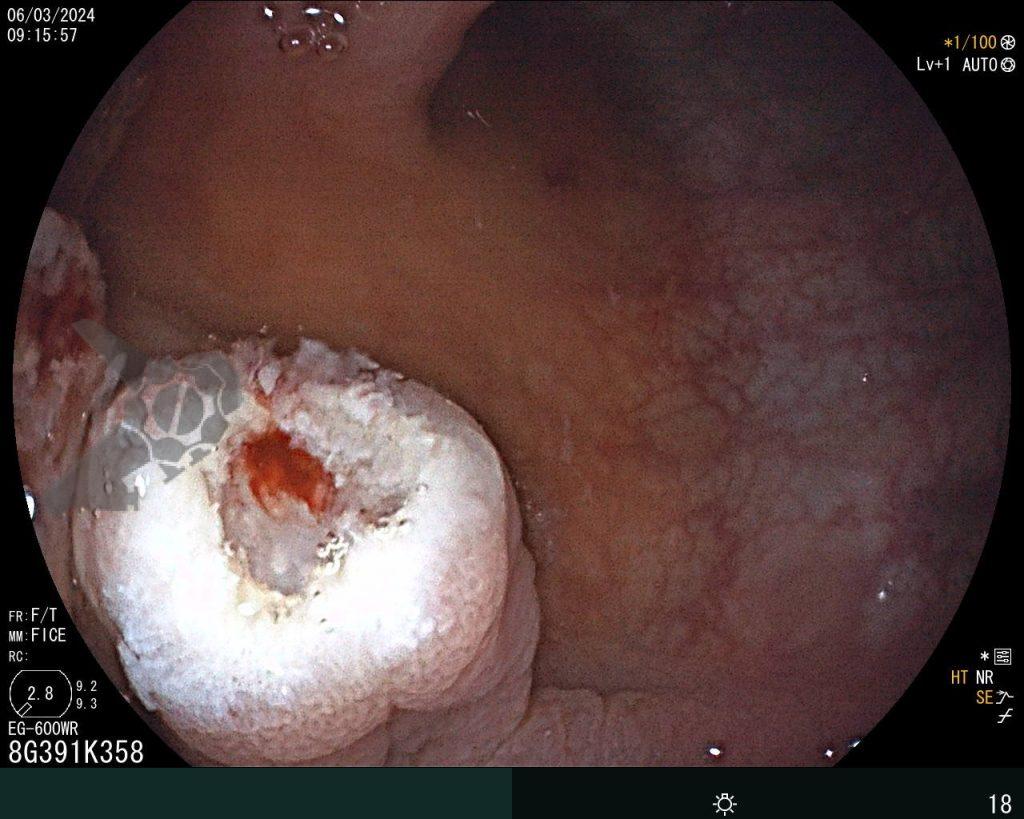
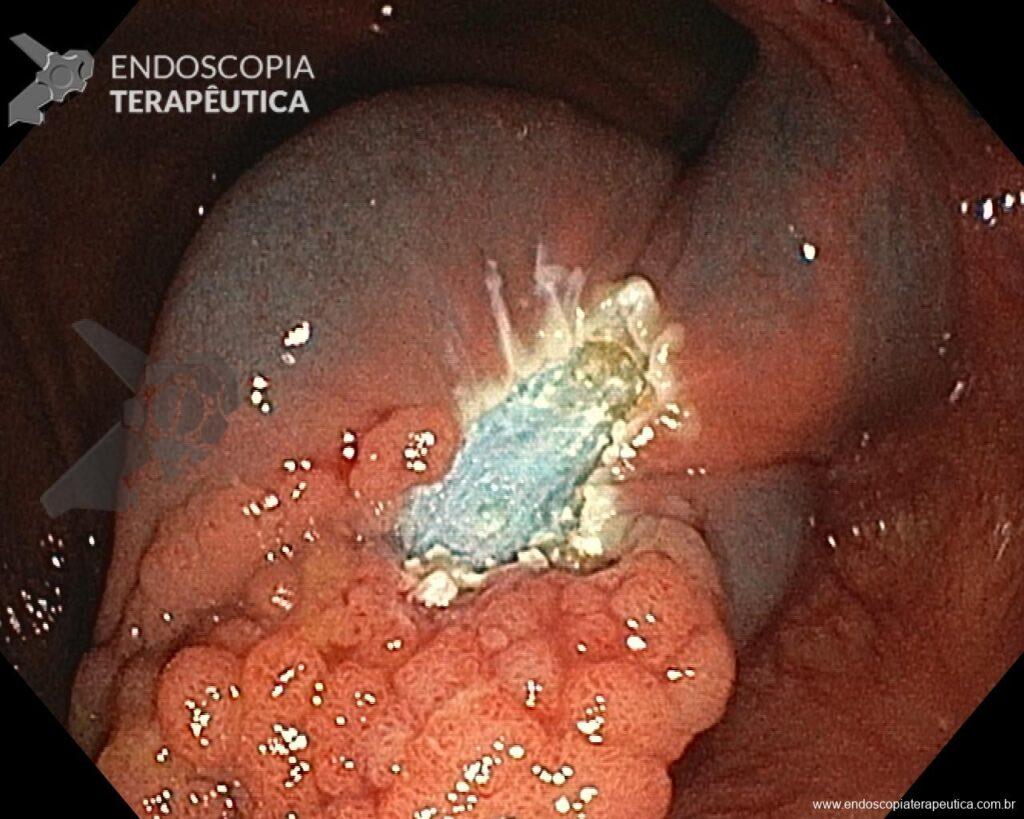
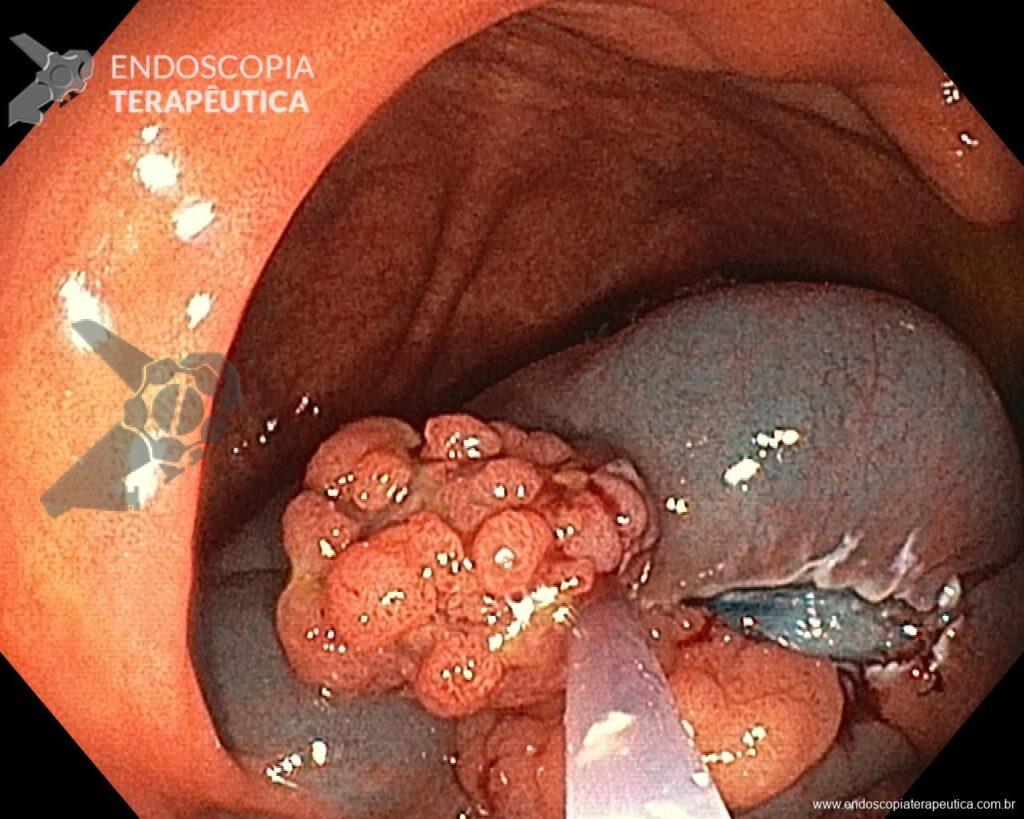
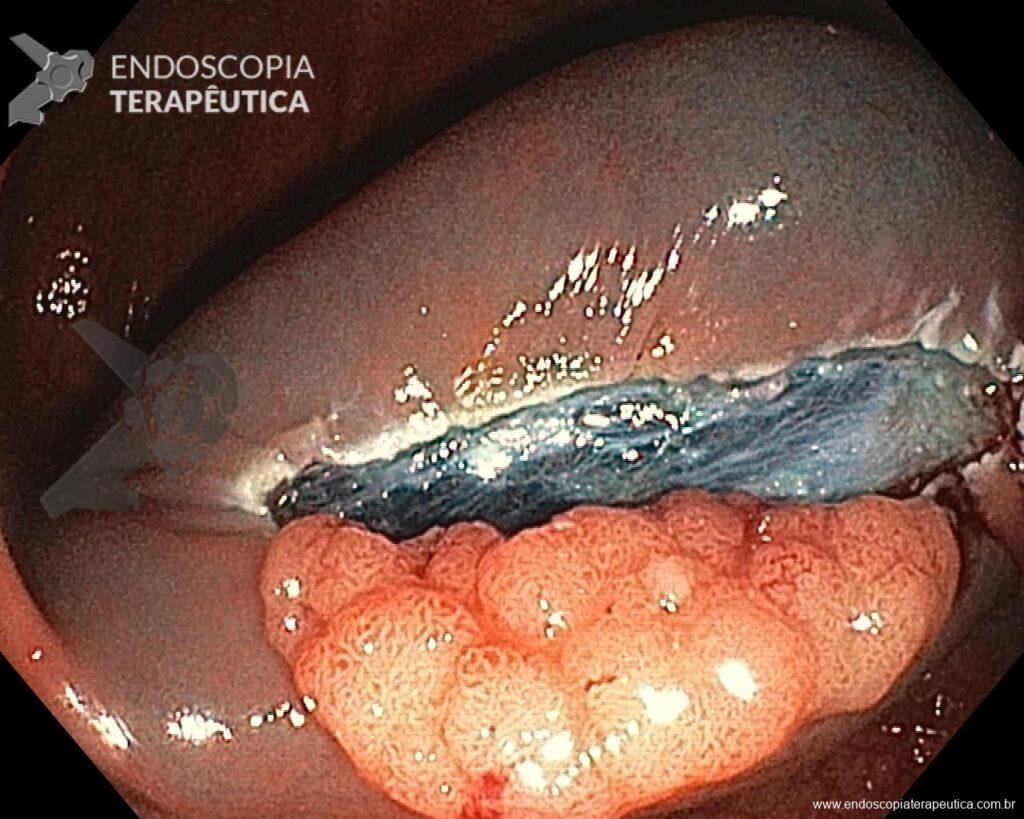
Una vez elegida la técnica de EPMR, tenga en mente que el objetivo debe ser la remoción completa de la lesión con la mayor seguridad posible. Para eso, la estrategia correcta es fundamental: no haga la burbuja submucosa toda de una vez, en vez de eso, haga inyecciones sucesivas seguidas del corte, preferentemente en el sentido proximal-distal; siempre que disponible, dé preferencia a soluciones viscosas, que garanticen una mayor patencia de la burbuja; utilice un asa más pequeña (10-15 mm) para sujetar la ampolla formulada; además de facilitar la operación, reduce el riesgo de perforación al intentar sujetar toda la lesión inadvertidamente.
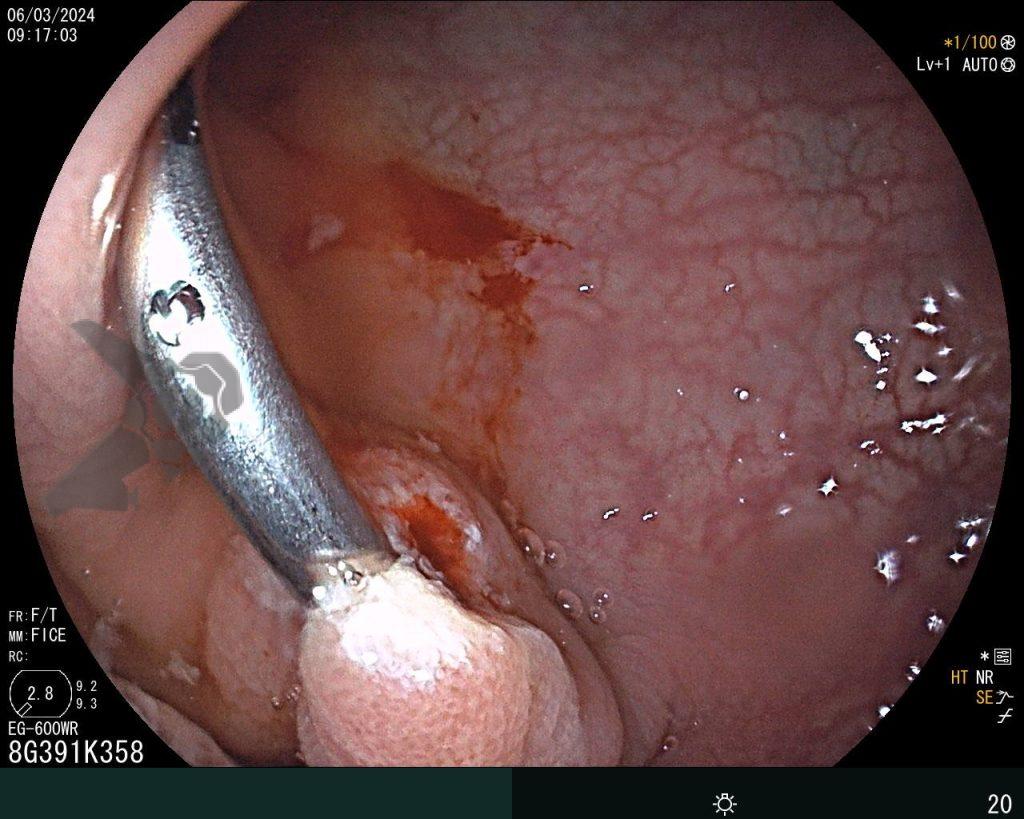
5. No se preocupe por el sangrado
Si experimenta un sangrado intraoperatorio (SIP), no se preocupe, es solo sangrado. Si bien es cierto que solo la experiencia práctica le dará confianza con el SIP, prepárese para abordarlo sistemáticamente, como lo haría con cualquier otro procedimiento endoscópico. Antes de comenzar el procedimiento, asegúrese de que su sala de endoscopia esté completamente equipada y sea capaz de manejar todo tipo de SIP. Use todo lo que pueda sin preocuparse. Use la bomba de lavado para extraer la sangre del tejido objetivo y limpiar el punto donde necesita intervenir. Si considera que el vaso es pequeño (hasta aproximadamente 2 mm), puede coagularlo inmediatamente con la punta del asa en modo de “coagulación suave”. Por otro lado, si el vaso es mayor de 2 mm, usar unas pinzas de coagulación es una estrategia más efectiva. Mientras espera el accesorio, si usa un tapón en la punta del dispositivo, úselo como un dedo y aplique presión sobre el vaso. Una vez que tenga listo el dispositivo, utilice de nuevo la bomba de agua para limpiar la zona, abra la pinza y sujete el vaso, tirando de él hacia usted (y alejándolo de la pared) antes de la coagulación. Se debe minimizar el uso de coagulación con plasma de argón (APC) durante la REM, al igual que los clips hemostáticos, que deben utilizarse cuando, tras haberlo intentado todo, el sangrado persiste.
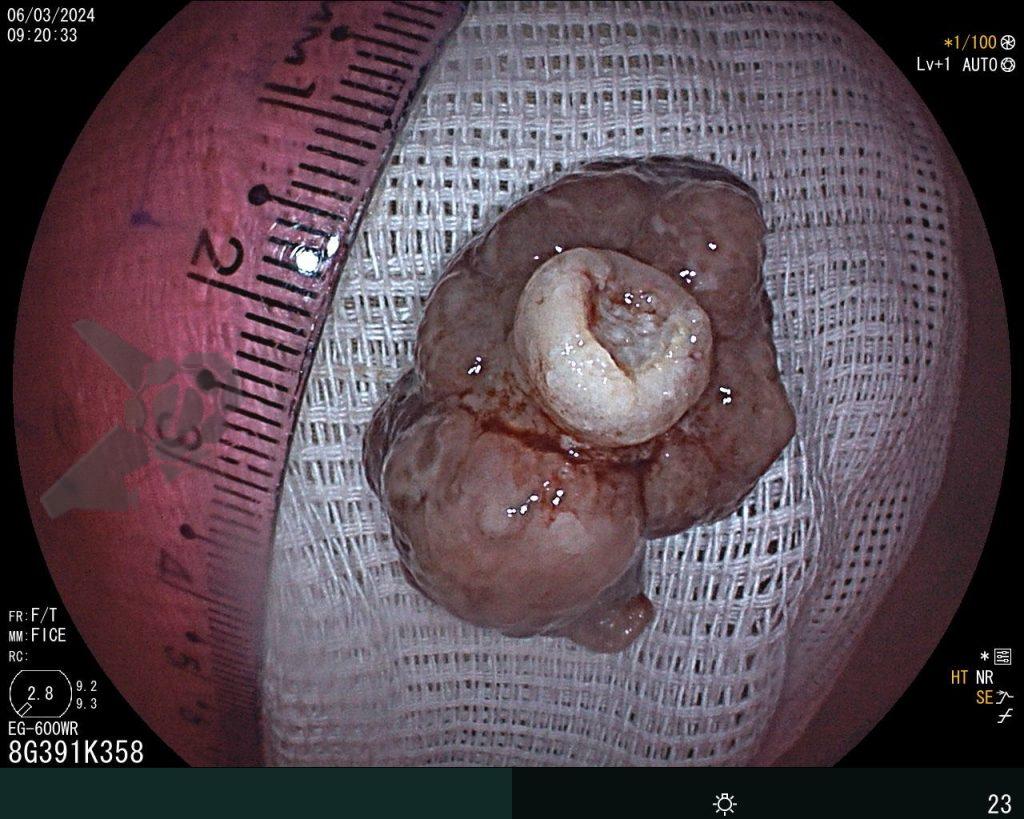
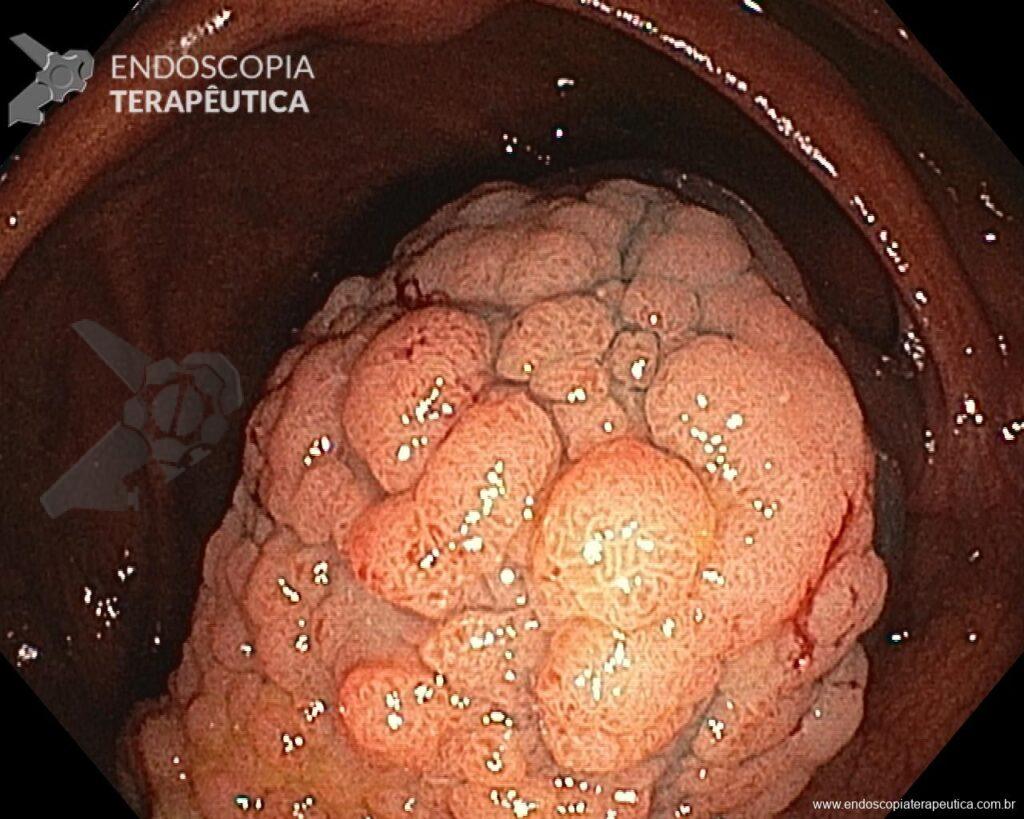
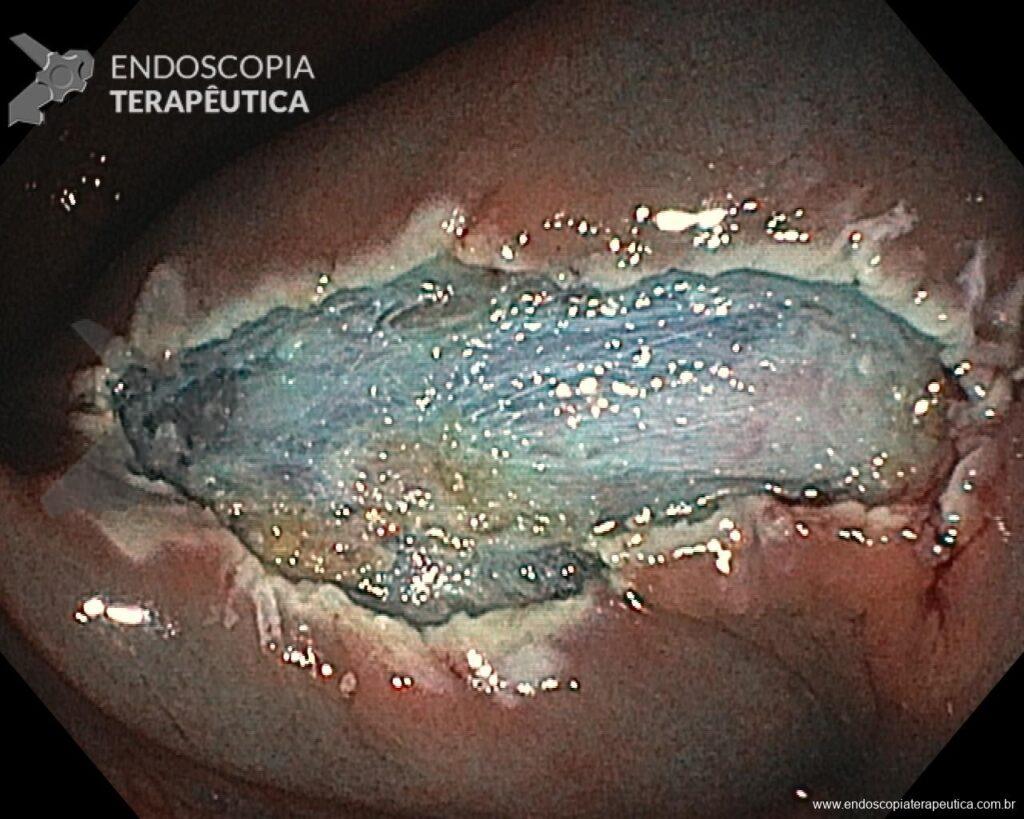
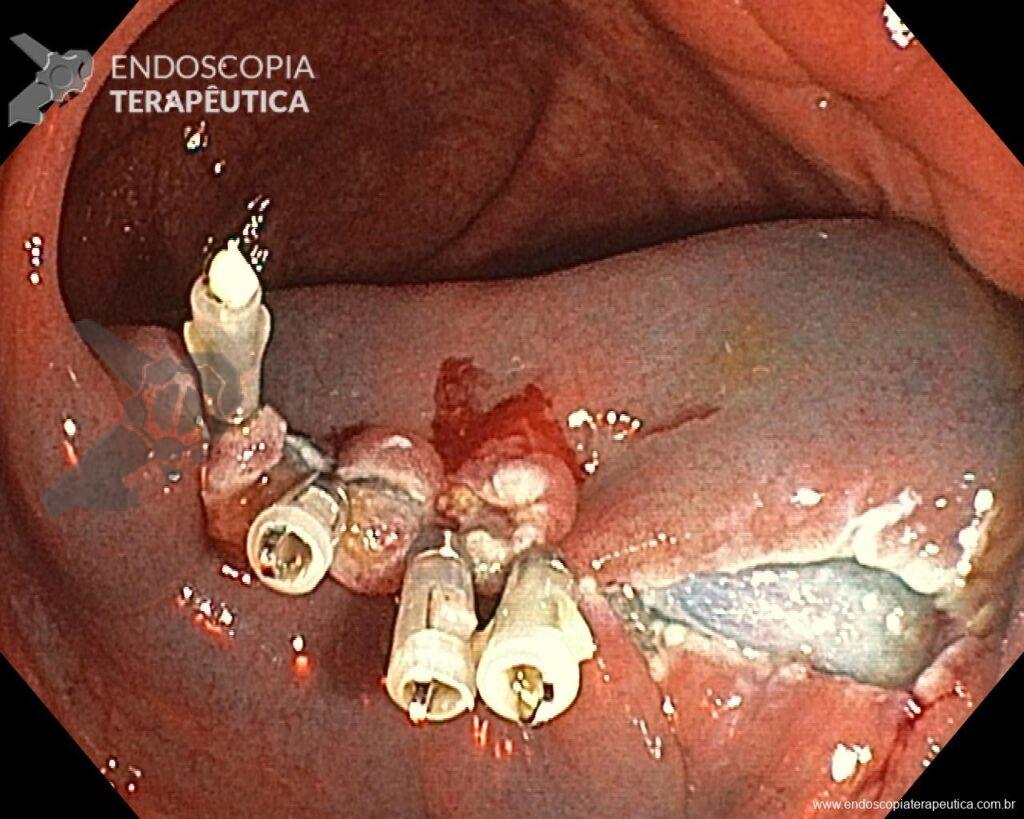
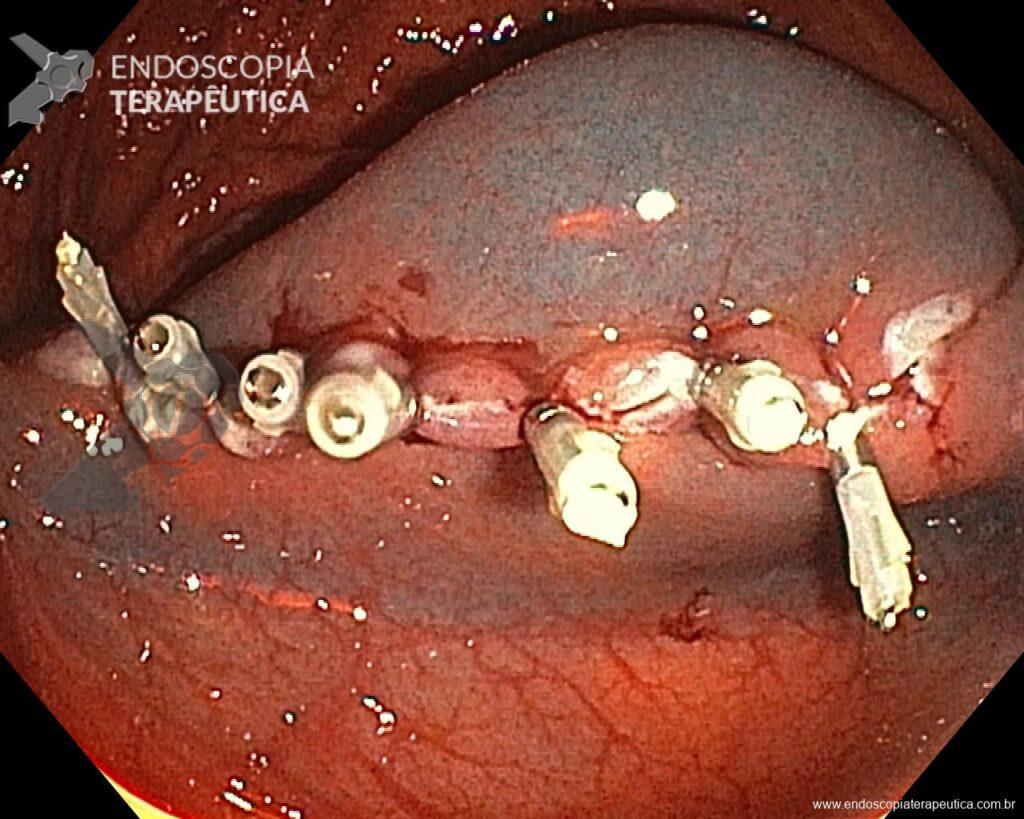
En vista de lo anterior, para el caso ejemplificado anteriormente, se optó por la resección mediante la técnica EPMR, tanto por el tipo morfológico (LST-G-H) y las características superficiales de la lesión (JNET 2A), como por su ubicación (ciego), que presenta un mayor riesgo de complicaciones.
Referencias
- Papparella L et al. Efficacy and safety of endoscopic resection techniques of large colorectal lesions: experience of a referral center in Italy. Eur J Gastroenterol Hepatol 2022; 34: 375–381.
- Ishigaki T et al. Treatment policy for colonic laterally spreading tumors based on each clinicopathologic feature of 4 subtypes: actual status of pseudo-depressed type. Gastrointest Endosc 2020; 92: 1083-94.
- Auriemma F and Repici A. Mistakes in endoscopic resection and how to avoid them. UEG Education 2017; 17: 27–29.
Como citar este artigo
Brasil G, Penaloza CSQ. Más vale una mucosectomía de colon en piecemeal (EPMR) bien hecha, que un intento de mucosectomía en bloque (EMR) frustrado – ¡Consejos para realizarla sin miedos! Endoscopia Terapéutica 2023, Vol. 2. Disponible en: https://endoscopiaterapeutica.net/es/casosclinicos/mas-vale-una-mucosectomia-de-colon-en-piecemeal-epmr-bien-hecha-que-un-intento-de-mucosectomia-en-bloque-emr-frustrado-consejos-para-realizarla-sin-miedos/