¿Sabes cómo interpretar un informe de cápsula endoscópica?
¿Ha recibido alguna vez un informe de una capsula endoscópica? ¿Conoce las limitaciones que pueden presentarse en su interpretación y las razones? Hoy le ayudaremos a comprender algunos puntos que le ayudarán a determinar el procedimiento a seguir con su paciente.
La capsula endoscópica ha supuesto avances significativos en la investigación del tracto gastrointestinal y cada vez está más disponible para los médicos. Sin embargo, su interpretación aún enfrenta importantes obstáculos, en particular la velocidad y trayectoria variables de la cápsula, así como la interpretación subjetiva de los hallazgos.
A continuación, abordaremos algunos puntos importantes que tanto quienes elaboran el informe como quienes lo reciben deben comprender, ya que, especialmente en estos últimos, puede haber confusión sobre cómo interpretarlo.
Este examen presenta algunas limitaciones técnicas:
- Campo de visión limitado: la cámara captura solo una porción de la mucosa, lo que podría dejar áreas sin registrar.
- Velocidad y trayectoria de tránsito variables: en algunos segmentos, la cápsula puede avanzar rápidamente, lo que reduce el número de imágenes disponibles. El tránsito intestinal rápido (examen breve) reduce la cantidad de muestras de la mucosa fotografiada.
- Calidad de la imagen: la presencia de restos de alimentos, burbujas y otros cuerpos extraños puede afectar la nitidez.
- Interpretación subjetiva: la interpretación depende de la experiencia del examinador. Lesiones discretas, como pequeñas erosiones o angiodisplasias, pueden pasar desapercibidas. No existe una estandarización universal para la descripción de los hallazgos y la limpieza intestinal, lo que puede generar variabilidad diagnóstica entre diferentes profesionales.
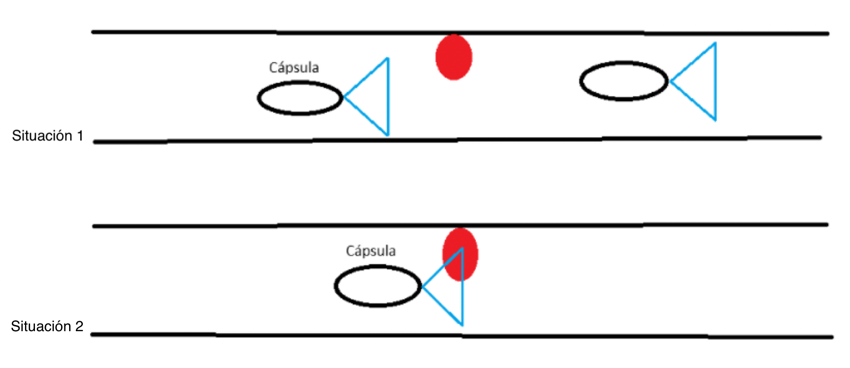
La velocidad de tránsito variable se debe a que el movimiento de la cápsula depende de la peristalsis intestinal natural. En algunos segmentos, la cápsula puede avanzar rápidamente, dejando espacios en blanco en la evaluación de la mucosa, e incluso en el intervalo entre una foto y otra, la cápsula puede pasar sobre una lesión sin registrarla (Figura 1; Situación 1).
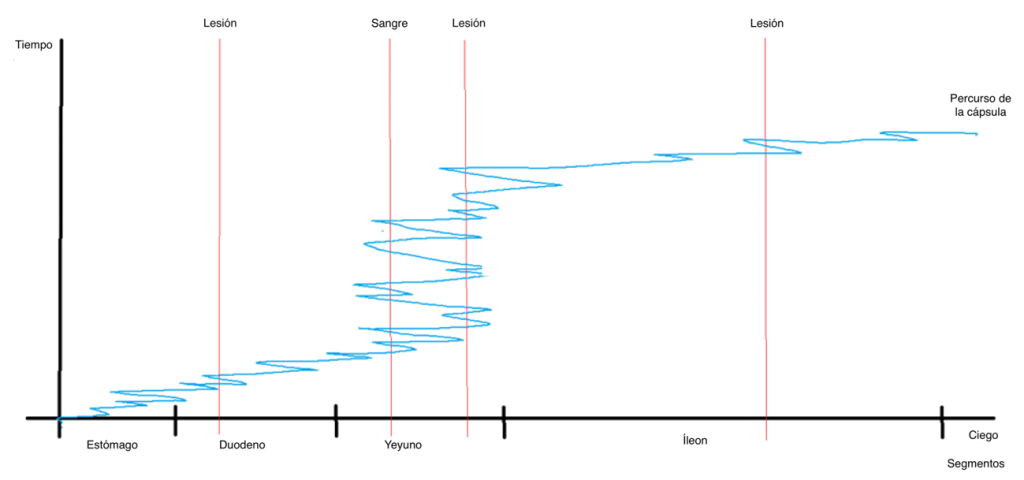
En otras ocasiones, puede permanecer en la misma región durante períodos prolongados, generando un exceso de imágenes redundantes. La Figura 2 ilustra una trayectoria aleatoria (línea azul) que la cápsula puede seguir en los segmentos intestinales. Esta irregularidad compromete la uniformidad de la documentación y aumenta el riesgo de que pequeñas lesiones pasen desapercibidas o de que se exagere el número real de lesiones. La Figura 2 muestra varios puntos:
- Una lesión puede registrarse varias veces, lo que puede dar lugar a la interpretación de que existen más lesiones;
- La cápsula no recorre el intestino en una sola dirección, sino que va y viene;
- La cápsula puede permanecer en un segmento durante mucho tiempo, ya que no tiene una dirección ni una velocidad uniformes.
Como la cápsula no tiene una velocidad uniforme ni una única dirección, puede ocurrir, por ejemplo, que en un examen en el que la cápsula recorrió el intestino delgado en 6 horas, permanezca en el duodeno y el yeyuno durante 5 horas, lo que dificultaría la localización precisa de las alteraciones encontradas. Para facilitar un posible enfoque terapéutico posterior, se recomienda dividir el tiempo total de recorrido por todo el intestino (en el ejemplo, 6 horas) en tres tercios iguales (proximal, medio y distal), lo cual realiza automáticamente el software, y registrar los hallazgos en estos tercios.
La interpretación subjetiva está relacionada con el papel central del médico en el análisis de las imágenes. Dado que el examen produce miles de fotografías, la identificación de alteraciones sutiles, como erosiones discretas, pequeñas úlceras o angiodisplasias, depende de la experiencia y la atención del examinador. Los residuos pueden simular u ocultar alteraciones, y la ausencia de una estandarización universal para la descripción de los hallazgos contribuye a la variabilidad diagnóstica entre diferentes profesionales. Por lo tanto, el resultado puede variar según la perspectiva clínica del intérprete (dependiente del examinador), lo que refuerza la necesidad de formación especializada y, cada vez más, del apoyo de software de inteligencia artificial para reducir los sesgos humanos.
El conocimiento de estas particularidades es importante tanto para quienes elaboran el informe como para quienes lo interpretan, ya que, considerando lo expuesto, es evidente que la cápsula ayuda más a determinar si existe alguna alteración que a determinar su ubicación y cuantificarla, y que la misma imagen puede generar discrepancias entre observadores.
Con el conocimiento de estos detalles, espero haber ayudado a los prescriptores a interpretar mejor el informe de este examen.
Referencias
- How to read wireless capsule endoscopic images: tips of the trade. Lewis, Blair S. Gastrointestinal Endoscopy Clinics, Volume 14, Issue 1, 11 – 16
- Rondonotti E, Spada C, Adler S, May A, Despott EJ, Koulaouzidis A, Panter S, Domagk D, Fernandez-Urien I, Rahmi G, Riccioni ME, van Hooft JE, Hassan C, Pennazio M. Small-bowel capsule endoscopy and device-assisted enteroscopy for diagnosis and treatment of small-bowel disorders: European Society of Gastrointestinal Endoscopy (ESGE) Technical Review. Endoscopy. 2018 Apr;50(4):423-446. doi: 10.1055/a-0576-0566. Epub 2018 Mar 14. PMID: 29539652.
- Pennazio M, Rondonotti E, Koulaouzidis A. Small Bowel Capsule Endoscopy: Normal Findings and Normal Variants of the Small Bowel. Gastrointest Endosc Clin N Am. 2017 Jan;27(1):29-50. doi: 10.1016/j.giec.2016.08.003. PMID: 27908517.
Cómo citar este artículo
Brito HP, Penaloza CSQ. ¿Sabes cómo interpretar un informe de cápsula endoscópica? Endoscopia Terapéutica 2026, Vol I. Disponible en: https://endoscopiaterapeutica.net/es/temas-generales/sabes-como-interpretar-un-informe-de-capsula-endoscopica/